DNA tamiri, DNA moleküllerindeki hataları onarım mekanzimalarını tanımlamak için kullanılan bir terimdir.
Bir canlıya ait tüm genetik bilgiyi taşıyan DNA molekülü doğal olarak veya çevresel faktörlerin etkisiyle sürekli hasara maruz kalmaktadır. İnsan hücrelerinde metabolik aktiviteler ve çevresel faktörler (UV ışığı gibi) sonucu günde 1 milyon hücrenin zarar görmesi olasıdır. Bu etkenler, DNA'nın yapısını ve dahası diğer nesillere aktarılan genetik bilgiyi değiştirebilirler. Bu değişimler yararlı olabileceği gibi, ölümcül sonuçalara nede olabilecek kadar zararlı da olabilirler. Bu yüzden, bütün canlı hücreleri, evrim süreçleri boyunca nesillere değişmeden aktarılması gereken DNA molekülünü koruma mekanizmaları geliştirmişlerdir.
Küçük hasarlar çoğunlukla DNA onarım sistemleri tarafından onarılır. Yüksek düzeydeki hasarlar apoptozisi uyararak "hücre ölümüne" yol açar. Böylelikle organizma kendini korumuş olur. Orta derecedeki hasarların birikimi ise mutasyonlara neden olur.
Hücre tüm bu DNA hasarlarına farklı metabolik yollar ile cevap verir. Ağır DNA hasarları hücrenin apoptozis yolunu aktive ederek hücreyi ölüme götürür. Hücre, DNA hasarlarını "DNA tamir mekanizmaları" ile tamir edebilir. DNA hasarı ikileşme sırasında tamir edilemezse mutasyona ve sonuç olarak genomik kararsızlığa, kanser ve yaşlanmaya neden olur.
DNA tamir sisteminde 100’den fazla gen rol oynar ve bu genlerin kodladığı proteinler tamir mekanizmalarında görev alırlar. Her bir insan hücresinin DNA'sında günde yaklaşık olarak 104 adet kodlanmayan veya yanlış kodlamaya neden olan hasar meydana gelmektedir. Mitokondrial DNA'da nokta mutasyonlarının birikiminin yaşa bağlı olarak arttığı, bu nedenle özellikle mitokondrideki oksidalif DNA hasarının yaşlanma ile ilişkili olduğu düşünülmektedir. DNA tamir mekanizmaları genomik kararlılığın devamını sağlayan sistemlerdir.
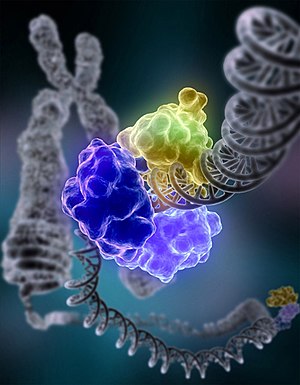
DNA tamir mekanizmalarından, DNA ligaz enzimi renkli olarak gösterilmiş.
O6-Metilguanin Tamiri
O6-Metilguanin (mG) alkilleyici ajanlar varlığında oluşur ve yüksek oranda mutajeniktir. O6-Metilguanin-DNA metil transferaz enzimi, DNA’daki yanlış metillenen bazların CH3 gruplarını kendi sistein rezidülerine transfer ederek normal Guanin oluşumunu sağlayar. Bunu yaparken enzim de geri dönüşümsüz olarak baskılanmış olur ve işlev dışı kalır. Böylece bu onarımda enzimin özgünlüğü kadar sayısı da önem kazanmaktadır.
Basit Tek Zincir Kırıklarının Ligasyonu
X-ışını ya da peroksitler gibi bazı ajanlar DNA zincirinde basit kırıklara neden olabilmektedir. Bir zincirde olan basit kırıklar DNA ligaz enzimi ile hemen tamir edilmektedir. DNA ligaz; enerji gerektiren bir reaksiyon ile 5' fosfat grubu ile 3'OH grubu arasındaki fosfodiester bağını oluşturur.
Baz Eksizyon Tamiri
Baz Eksizyon Tamiri, DNA bazlarının doğal hidrolizi veya kimyasal ajanlar nedeni ile oluşan uygun olmayan bazların tamiri ile ilgilidir. BER’de görev alan enzim DNA glikozilazdır. Spontan veya kimyasallarla olan deaminasyon veya iyonize radyasyon ve oksidatif hasar sonucu oluşan baz değişikliklerine spesifiktir (urasil, hipoksantin, 3-metiladenin vb.). DNA glikozilaz, uygun olmayan bazı tanır. Deoksiriboz şeker ve baz arasındaki N-glikozidik bağın hidrolizi ile uzaklaştırır. Lezyona spesifik glikozilaz enzim formu kullanılır (Örn: Urasil-DNA glikozilaz). Abazik (apirimidinik ya da apürinik) bölge oluşur (AP bölge). AP bölgeyi spesifik AP endonükleaz enzimleri tanır ve bu zincirde bir çentik açar. Ekzonükleaz enzimi fosfat ve şekeri ayırır. Oluşan boşluk DNA polimeraz ile doldurulur ve ligaz ile fosfodiester bağlantı sağlanır (Glikozilaz, metillenmiş sitozinden amino grubunun uzaklaşmasıyla oluşan timini DNA’dan çıkartamaz, çünkü timin DNA için normal bir bazdır).
Nükleotid Eksizyon Tamiri (NER)
DNA'nın sarmal yapısında geniş bozulmalara neden olan DNA lezyonları NER sistemi ile onarılır. UV kaynaklı pirimidin dimerleri, sigara nedenli benzopiren-guanin gibi baz değişimleri, kemoterapötik ilaçlarla oluşan baz değişimleri BER’de bazlar tek olarak kesip çıkarılırken, NER’de hasarlı bazlar oligonükleotid parçaları olarak kesip çıkarılır. Prokaryotlarda anahtar enzimatik kompleks ABC ekzinükleazdır. 3 altünitesi vardır.:
Ekzinükleaz aktivitesi birçok gen tarafından kodlanan proteinlerce gerçekleştirilir. DNA’daki hasar XPA proteini ile tanınır ve diğer proteinlerin bu bölgeye gelmeleri sağlanır. [Transkripsiyon faktörü II H (TFIIH), XPA ve replikasyon proteini A (RPA)] TFIIH’nin alt birimlerinden XPB ve XPD’nin helikaz aktiviteleri ile DNA zincirinde 20 nükleotidlik bir bölge açılır (unwinding). XPG proteini 3' uç bölgesinde hasardan 6 nükleotid uzaktan, XPF/ERCC1 protein kompleksi ise 5' uç bölgesinde hasardan 22 nükleotid uzaktan DNA zincirini keser. Serbest kalan 27–29 nükleotidlik parça uzaklaştırılır.
Nükleotid Eksizyon Tamir Genleri
Memelilerde eksizyon tamir yolunun moleküler mekanizmasını araştırmak amacıyla NER hasarı olan iki mutant hücre hattı kullanılmıştır: Laboratuarda oluşturulan UV'ye duyarlı hamster hücre hatları ve doğal insan mutantları XP, CS ve TTD'nin hücre hatları. Hücre füzyon çalışmaları sonucunda XP'da XPA, XPB, XPC, XPD, XPE, XPF ve XPG olmak üzere 7; CS' de iki (CSA ve CSB); TTD' de ise üç (XPB, XPD ve TTD A) komplementasyon grubu tanımlanmıştır. Bu hasta gruplarının hücre hatlarına ek olarak, mutant hamster hücre hatları arasında 11 komplementasyon grubu tanımlanmıştır. Mutant hamster hücrelerinin insan genomik DNA ile transfeksiyonu sonucunda insan DNA’sı ile hamster hücrelerinin mutant fenotipi düzeltilmiş ve ERCC (excision repair cross complementing) genleri tanımlanmıştır. Komplementasyon analizleri ERCC2'nin XPD, ERCC3'ün XPB, ERCC5'in XPG ve ERCC6'nın CSB geni ile benzer olduğunu ortaya çıkarmıştır.
Nükleotid Eksizyon Tamir Mekanizması
Son yıllarda yapılan araştırmalar, eşleşmeyen DNA zincirindeki DNA adüktlerinin XPC/hHR23B kompleksi ile tanındığını ortaya koymuştur. XPC/hHR23B kompleksinin hasara bağlanması DNA yapısının kısmen açılmasına neden olmakta ve tamir mekanizmasında görev alan diğer proteinlerin bu bölgeye toplanmasını ve bağlanmasını sağlamaktadır. DNA zincirindeki bu açılma, Transkripsiyon faktörü II H (TFIIH)'nin, XPA ve replikasyon proteini A (RPA)'nın, hasarlı bölgeye girerek açık DNA kompleksini meydana getirmesine neden olmaktadır. Transkripsiyonda ve DNA tamirinde görev alan TFIIH 9 alt biriminden meydana gelmektedir ve alt birimlerden XPB 3'-->5' ve XPD 5'-->3' helikaz aktivitelerine sahiptir. Helikaz aktiviteleri nedeniyle, TFIIH DNA zincirinin 20-30 nükleotidlik bir bölgenin açılmasını sağlar. Daha sonra, hasarlı zincir üzerinde sırayla kesim olayı gerçekleşir. XPG proteini 3' bölgesinde, hasardan 2-8 nükleotid uzaklıktan keser.
XPF/ERCC1 ise 5' bölgesinde hasardan 15-24 nükleotid uzaklıktan keser. Hasarlı bölgeyi içeren 24-32 nükleotidlik oligonükleotid serbest bırakılır. Serbest bırakılan bu oligonükleotid, hasarı tanıyan proteinlerden XPC/hHR23B proteinine bağlı olarak ortamdan uzaklaştırılır. DNA zincirindeki boşluk, DNA replikasyon faktörü C (RFC), prolifere edici hücre nükleer antijeni (PCNA) ve DNA polimerazlar δ ve ε ile doldurulur. PCNA, RFC ile birlikte DNA kalıbı üzerine DNA polimerazlar δ ve ε 'un yüklenmesini sağlar. NER mekanizmasındaki son basamak, PCNA proteininin ayrılması ve ligaz I enzimi ile yeni sentezlenen DNA zincirinin ligasyonudur
Transkripsiyona Kenetlenmiş Tamir Mekanizması
İnsan tamir genlerinin tanımlanması ve klonlanmasıyla DNA tamiri ve transkripsiyon arasındaki moleküler ilişki açıklık kazanmıştır. Yapılan araştırmalar, genlerin okunan zincirinin okunmayan zincirden daha hızlı bir şekilde NER yoluyla tamir edildiğini ortaya koymuştur. Transkripsiyon sırasında RNA polimeraz II, DNA zincirinde hasarla karşılaştığında RNA sentezi durur ve TCR yolu bu hasarın tamirinde rol oynar. TCR mekanizmasında, GGR yolundan farklı olarak hasarın tanınma basamağında XPC/hHR23B kompleksi yerine CSB proteini rol oynar. CSB proteini, RNA polimeraz II'yi ubiquitin ile birleştirerek parçalanmasını ve böylece TFIIH, XPA ve RPA proteinlerinin hasarlı bölgeye ulaşmasını sağlar. TCR yolundaki diğer basamaklar GGR yolundaki basamaklar ile aynıdır.
NER mekanizmasında rol alan proteinlerdeki bozukluklar sonucunda bazı nadir görülen hastalıklar tanımlanmıştır;
Transkripsiyona Kenetlenmiş Tamir Mekanizması
İnsan tamir genlerinin tanımlanması ve klonlanmasıyla DNA tamiri ve transkripsiyon arasındaki moleküler ilişki açıklık kazanmıştır. Yapılan araştırmalar, genlerin okunan zincirinin okunmayan zincirden daha hızlı bir şekilde NER yoluyla tamir edildiğini ortaya koymuştur. Transkripsiyon sırasında RNA polimeraz II, DNA zincirinde hasarla karşılaştığında RNA sentezi durur ve TCR yolu bu hasarın tamirinde rol oynar. TCR mekanizmasında, GGR yolundan farklı olarak hasarın tanınma basamağında XPC/hHR23B kompleksi yerine CSB proteini rol oynar. CSB proteini, RNA polimeraz II'yi ubiquitin ile birleştirerek parçalanmasını ve böylece TFIIH, XPA ve RPA proteinlerinin hasarlı bölgeye ulaşmasını sağlar. TCR yolundaki diğer basamaklar GGR yolundaki basamaklar ile aynıdır.
NER mekanizmasında rol alan proteinlerdeki bozukluklar sonucunda bazı nadir görülen hastalıklar tanımlanmıştır;
Rekombinasyonal Tamiri
DNA hasarı diğer tamir sistemleri ile tamir edilememişse, replikasyondan sonra aktif olan mekanizmadır. Bir lezyon bulunduran DNA replike olurken, DNA polimeraz önce lezyonda duraklar. Hasarlı bölgeyi de içine alacak şekilde boşluk bırakarak atlar ve senteze devam eder. Rec A proteini, rekombinasyonal bir değiş tokuş işlemi ile hasarsız komplementer zincirde bulunan sekansı transfer eder. Komplementer zincirde oluşan boşluk DNA polimeraz – DNA ligaz enzimleri sayesinde doldurulur. Halen bulunan lezyon diğer tamir sistemleri ile onarılır.
SOS Tamiri
DNA hasarının yüksek oranda olduğu ve diğer tamir mekanizmalarının başarılı olamadığı durumlarda devreye giren acil cevap sistemidir. DNA sentezi sırasında, bir lezyonun üzerinden atlamak yerine, sistem, DNA polimerazın lezyon karşısında replikasyonu devam ettirmesini sağlar. Fakat replikasyonun doğruluğundan fedakârlık edilir. Bu nedenle hataya meyilli sistem de denir. SOS yanıtında görev alan birçok proteini kodlayan genler normalde Lex A proteini tarafından baskılanmış durumdadır. DNA hasarı ile karşılaşıldığında, Rec A proteini hasarlı tek zincire bağlanır ve Rec A-ssDNA kompleksi oluşur. Rec A, DNA’ya bağlandıktan sonra Lex A proteininin otoproteolitik yıkımını aktive eder. Rec A, DNA polimeraza bağlanır ve lezyonu da geçerek DNA’yı replike etmesini sağlar. umu C-umu D kompleksi etkisiyle ve Rec A’nın, polimerazın 3'-->5' ekzonükleaz (hata okuma ve çıkarma) aktivitesini inhibe etmesiyle translezyon replikasyon gerçekleşir. Hataya meyilli tamir sistemidir.
Çift Zincir Kırıklarının Tamiri
İyonize radyasyon, oksidatif hasar sonucu veya doğal oluşan DNA çift zincir kırıkları iki şekilde tamir edilir;
NHEJ
Hızlı ve hataya meyilli bir sistemdir. Ku 70-Ku 80 kompleksleri DNA kırık uçlarına bağlanırlar. DNA bağımlı protein kinaz aktive olarak diğer proteinlerin hasar bölgesine gelmelerini sağlar. Bu protein komplekslerinin formasyonu DNA ligaz IV-XRCC4 kompleksinin kırık uçları bağlamasını sağlar.
Homolog rekombinasyon
RAD ve BRCA genleri tarafından yönlendirilir. MRE11-RAD50-NBS1 kompleksinin nükleaz aktivitesi ile kırık uçları degredasyona uğrar. RAD 52 proteini 3' uçlara bağlanır. RAD 51- BRCA 2 kompleksi, rekombinasyon oluşturmak üzere kardeş kromatid zincirinin hasar bölgesine invazyonunu sağlar. Bu zincir kalıp olarak kullanılarak sentez yapılır ve hasar onarılır (DNA polimeraz – DNA ligaz).
NHEJ tamir yolundaki hataların çeşitli kanserler ile ilişkili translokasyonlara neden olduğu gösterilmiştir. Burkitt lenfoma KML – Philadelphia kromozomu. Homolog rekombinasyonda görev alan BRCA1 ve BRCA2 genlerinde olan mutasyonlar ile meme ve rahim kanserleri arasında ilişki bulunmuştur.
Homolog olmayan rekombinasyon - NHEJ (Non-Homologous End-Joining)
Serbest iki DNA ucu tamir edilene kadar birarada tutulurlar (sinapsis).
- Kromatin yapısında değişmeler - Dna-Protein etkileşimleri - Protein-Protein etkileşimleri
Bir canlıya ait tüm genetik bilgiyi taşıyan DNA molekülü doğal olarak veya çevresel faktörlerin etkisiyle sürekli hasara maruz kalmaktadır. İnsan hücrelerinde metabolik aktiviteler ve çevresel faktörler (UV ışığı gibi) sonucu günde 1 milyon hücrenin zarar görmesi olasıdır. Bu etkenler, DNA'nın yapısını ve dahası diğer nesillere aktarılan genetik bilgiyi değiştirebilirler. Bu değişimler yararlı olabileceği gibi, ölümcül sonuçalara nede olabilecek kadar zararlı da olabilirler. Bu yüzden, bütün canlı hücreleri, evrim süreçleri boyunca nesillere değişmeden aktarılması gereken DNA molekülünü koruma mekanizmaları geliştirmişlerdir.
Sponsorlu Bağlantılar
Hücre tüm bu DNA hasarlarına farklı metabolik yollar ile cevap verir. Ağır DNA hasarları hücrenin apoptozis yolunu aktive ederek hücreyi ölüme götürür. Hücre, DNA hasarlarını "DNA tamir mekanizmaları" ile tamir edebilir. DNA hasarı ikileşme sırasında tamir edilemezse mutasyona ve sonuç olarak genomik kararsızlığa, kanser ve yaşlanmaya neden olur.
DNA tamir sisteminde 100’den fazla gen rol oynar ve bu genlerin kodladığı proteinler tamir mekanizmalarında görev alırlar. Her bir insan hücresinin DNA'sında günde yaklaşık olarak 104 adet kodlanmayan veya yanlış kodlamaya neden olan hasar meydana gelmektedir. Mitokondrial DNA'da nokta mutasyonlarının birikiminin yaşa bağlı olarak arttığı, bu nedenle özellikle mitokondrideki oksidalif DNA hasarının yaşlanma ile ilişkili olduğu düşünülmektedir. DNA tamir mekanizmaları genomik kararlılığın devamını sağlayan sistemlerdir.

DNA tamir mekanizmalarından, DNA ligaz enzimi renkli olarak gösterilmiş.
O6-Metilguanin (mG) alkilleyici ajanlar varlığında oluşur ve yüksek oranda mutajeniktir. O6-Metilguanin-DNA metil transferaz enzimi, DNA’daki yanlış metillenen bazların CH3 gruplarını kendi sistein rezidülerine transfer ederek normal Guanin oluşumunu sağlayar. Bunu yaparken enzim de geri dönüşümsüz olarak baskılanmış olur ve işlev dışı kalır. Böylece bu onarımda enzimin özgünlüğü kadar sayısı da önem kazanmaktadır.
Basit Tek Zincir Kırıklarının Ligasyonu
X-ışını ya da peroksitler gibi bazı ajanlar DNA zincirinde basit kırıklara neden olabilmektedir. Bir zincirde olan basit kırıklar DNA ligaz enzimi ile hemen tamir edilmektedir. DNA ligaz; enerji gerektiren bir reaksiyon ile 5' fosfat grubu ile 3'OH grubu arasındaki fosfodiester bağını oluşturur.
Baz Eksizyon Tamiri
Baz Eksizyon Tamiri, DNA bazlarının doğal hidrolizi veya kimyasal ajanlar nedeni ile oluşan uygun olmayan bazların tamiri ile ilgilidir. BER’de görev alan enzim DNA glikozilazdır. Spontan veya kimyasallarla olan deaminasyon veya iyonize radyasyon ve oksidatif hasar sonucu oluşan baz değişikliklerine spesifiktir (urasil, hipoksantin, 3-metiladenin vb.). DNA glikozilaz, uygun olmayan bazı tanır. Deoksiriboz şeker ve baz arasındaki N-glikozidik bağın hidrolizi ile uzaklaştırır. Lezyona spesifik glikozilaz enzim formu kullanılır (Örn: Urasil-DNA glikozilaz). Abazik (apirimidinik ya da apürinik) bölge oluşur (AP bölge). AP bölgeyi spesifik AP endonükleaz enzimleri tanır ve bu zincirde bir çentik açar. Ekzonükleaz enzimi fosfat ve şekeri ayırır. Oluşan boşluk DNA polimeraz ile doldurulur ve ligaz ile fosfodiester bağlantı sağlanır (Glikozilaz, metillenmiş sitozinden amino grubunun uzaklaşmasıyla oluşan timini DNA’dan çıkartamaz, çünkü timin DNA için normal bir bazdır).
Nükleotid Eksizyon Tamiri (NER)
DNA'nın sarmal yapısında geniş bozulmalara neden olan DNA lezyonları NER sistemi ile onarılır. UV kaynaklı pirimidin dimerleri, sigara nedenli benzopiren-guanin gibi baz değişimleri, kemoterapötik ilaçlarla oluşan baz değişimleri BER’de bazlar tek olarak kesip çıkarılırken, NER’de hasarlı bazlar oligonükleotid parçaları olarak kesip çıkarılır. Prokaryotlarda anahtar enzimatik kompleks ABC ekzinükleazdır. 3 altünitesi vardır.:
- uvr A,
- uvr B,
- uvr C)
Ekzinükleaz aktivitesi birçok gen tarafından kodlanan proteinlerce gerçekleştirilir. DNA’daki hasar XPA proteini ile tanınır ve diğer proteinlerin bu bölgeye gelmeleri sağlanır. [Transkripsiyon faktörü II H (TFIIH), XPA ve replikasyon proteini A (RPA)] TFIIH’nin alt birimlerinden XPB ve XPD’nin helikaz aktiviteleri ile DNA zincirinde 20 nükleotidlik bir bölge açılır (unwinding). XPG proteini 3' uç bölgesinde hasardan 6 nükleotid uzaktan, XPF/ERCC1 protein kompleksi ise 5' uç bölgesinde hasardan 22 nükleotid uzaktan DNA zincirini keser. Serbest kalan 27–29 nükleotidlik parça uzaklaştırılır.
Nükleotid Eksizyon Tamir Genleri
Memelilerde eksizyon tamir yolunun moleküler mekanizmasını araştırmak amacıyla NER hasarı olan iki mutant hücre hattı kullanılmıştır: Laboratuarda oluşturulan UV'ye duyarlı hamster hücre hatları ve doğal insan mutantları XP, CS ve TTD'nin hücre hatları. Hücre füzyon çalışmaları sonucunda XP'da XPA, XPB, XPC, XPD, XPE, XPF ve XPG olmak üzere 7; CS' de iki (CSA ve CSB); TTD' de ise üç (XPB, XPD ve TTD A) komplementasyon grubu tanımlanmıştır. Bu hasta gruplarının hücre hatlarına ek olarak, mutant hamster hücre hatları arasında 11 komplementasyon grubu tanımlanmıştır. Mutant hamster hücrelerinin insan genomik DNA ile transfeksiyonu sonucunda insan DNA’sı ile hamster hücrelerinin mutant fenotipi düzeltilmiş ve ERCC (excision repair cross complementing) genleri tanımlanmıştır. Komplementasyon analizleri ERCC2'nin XPD, ERCC3'ün XPB, ERCC5'in XPG ve ERCC6'nın CSB geni ile benzer olduğunu ortaya çıkarmıştır.
Nükleotid Eksizyon Tamir Mekanizması
Son yıllarda yapılan araştırmalar, eşleşmeyen DNA zincirindeki DNA adüktlerinin XPC/hHR23B kompleksi ile tanındığını ortaya koymuştur. XPC/hHR23B kompleksinin hasara bağlanması DNA yapısının kısmen açılmasına neden olmakta ve tamir mekanizmasında görev alan diğer proteinlerin bu bölgeye toplanmasını ve bağlanmasını sağlamaktadır. DNA zincirindeki bu açılma, Transkripsiyon faktörü II H (TFIIH)'nin, XPA ve replikasyon proteini A (RPA)'nın, hasarlı bölgeye girerek açık DNA kompleksini meydana getirmesine neden olmaktadır. Transkripsiyonda ve DNA tamirinde görev alan TFIIH 9 alt biriminden meydana gelmektedir ve alt birimlerden XPB 3'-->5' ve XPD 5'-->3' helikaz aktivitelerine sahiptir. Helikaz aktiviteleri nedeniyle, TFIIH DNA zincirinin 20-30 nükleotidlik bir bölgenin açılmasını sağlar. Daha sonra, hasarlı zincir üzerinde sırayla kesim olayı gerçekleşir. XPG proteini 3' bölgesinde, hasardan 2-8 nükleotid uzaklıktan keser.
XPF/ERCC1 ise 5' bölgesinde hasardan 15-24 nükleotid uzaklıktan keser. Hasarlı bölgeyi içeren 24-32 nükleotidlik oligonükleotid serbest bırakılır. Serbest bırakılan bu oligonükleotid, hasarı tanıyan proteinlerden XPC/hHR23B proteinine bağlı olarak ortamdan uzaklaştırılır. DNA zincirindeki boşluk, DNA replikasyon faktörü C (RFC), prolifere edici hücre nükleer antijeni (PCNA) ve DNA polimerazlar δ ve ε ile doldurulur. PCNA, RFC ile birlikte DNA kalıbı üzerine DNA polimerazlar δ ve ε 'un yüklenmesini sağlar. NER mekanizmasındaki son basamak, PCNA proteininin ayrılması ve ligaz I enzimi ile yeni sentezlenen DNA zincirinin ligasyonudur
Transkripsiyona Kenetlenmiş Tamir Mekanizması
İnsan tamir genlerinin tanımlanması ve klonlanmasıyla DNA tamiri ve transkripsiyon arasındaki moleküler ilişki açıklık kazanmıştır. Yapılan araştırmalar, genlerin okunan zincirinin okunmayan zincirden daha hızlı bir şekilde NER yoluyla tamir edildiğini ortaya koymuştur. Transkripsiyon sırasında RNA polimeraz II, DNA zincirinde hasarla karşılaştığında RNA sentezi durur ve TCR yolu bu hasarın tamirinde rol oynar. TCR mekanizmasında, GGR yolundan farklı olarak hasarın tanınma basamağında XPC/hHR23B kompleksi yerine CSB proteini rol oynar. CSB proteini, RNA polimeraz II'yi ubiquitin ile birleştirerek parçalanmasını ve böylece TFIIH, XPA ve RPA proteinlerinin hasarlı bölgeye ulaşmasını sağlar. TCR yolundaki diğer basamaklar GGR yolundaki basamaklar ile aynıdır.
NER mekanizmasında rol alan proteinlerdeki bozukluklar sonucunda bazı nadir görülen hastalıklar tanımlanmıştır;
- Xeroderma pigmentosum (XP proteinleri)
- Cockayne sendromu (CSA-CSB)
- Trikotiyodistrofi (XP proteinleri)
Transkripsiyona Kenetlenmiş Tamir Mekanizması
İnsan tamir genlerinin tanımlanması ve klonlanmasıyla DNA tamiri ve transkripsiyon arasındaki moleküler ilişki açıklık kazanmıştır. Yapılan araştırmalar, genlerin okunan zincirinin okunmayan zincirden daha hızlı bir şekilde NER yoluyla tamir edildiğini ortaya koymuştur. Transkripsiyon sırasında RNA polimeraz II, DNA zincirinde hasarla karşılaştığında RNA sentezi durur ve TCR yolu bu hasarın tamirinde rol oynar. TCR mekanizmasında, GGR yolundan farklı olarak hasarın tanınma basamağında XPC/hHR23B kompleksi yerine CSB proteini rol oynar. CSB proteini, RNA polimeraz II'yi ubiquitin ile birleştirerek parçalanmasını ve böylece TFIIH, XPA ve RPA proteinlerinin hasarlı bölgeye ulaşmasını sağlar. TCR yolundaki diğer basamaklar GGR yolundaki basamaklar ile aynıdır.
NER mekanizmasında rol alan proteinlerdeki bozukluklar sonucunda bazı nadir görülen hastalıklar tanımlanmıştır;
- Xeroderma pigmentosum (XP proteinleri)
- Cockayne sendromu (CSA-CSB)
- Trikotiyodistrofi (XP proteinleri)
Rekombinasyonal Tamiri
DNA hasarı diğer tamir sistemleri ile tamir edilememişse, replikasyondan sonra aktif olan mekanizmadır. Bir lezyon bulunduran DNA replike olurken, DNA polimeraz önce lezyonda duraklar. Hasarlı bölgeyi de içine alacak şekilde boşluk bırakarak atlar ve senteze devam eder. Rec A proteini, rekombinasyonal bir değiş tokuş işlemi ile hasarsız komplementer zincirde bulunan sekansı transfer eder. Komplementer zincirde oluşan boşluk DNA polimeraz – DNA ligaz enzimleri sayesinde doldurulur. Halen bulunan lezyon diğer tamir sistemleri ile onarılır.
SOS Tamiri
DNA hasarının yüksek oranda olduğu ve diğer tamir mekanizmalarının başarılı olamadığı durumlarda devreye giren acil cevap sistemidir. DNA sentezi sırasında, bir lezyonun üzerinden atlamak yerine, sistem, DNA polimerazın lezyon karşısında replikasyonu devam ettirmesini sağlar. Fakat replikasyonun doğruluğundan fedakârlık edilir. Bu nedenle hataya meyilli sistem de denir. SOS yanıtında görev alan birçok proteini kodlayan genler normalde Lex A proteini tarafından baskılanmış durumdadır. DNA hasarı ile karşılaşıldığında, Rec A proteini hasarlı tek zincire bağlanır ve Rec A-ssDNA kompleksi oluşur. Rec A, DNA’ya bağlandıktan sonra Lex A proteininin otoproteolitik yıkımını aktive eder. Rec A, DNA polimeraza bağlanır ve lezyonu da geçerek DNA’yı replike etmesini sağlar. umu C-umu D kompleksi etkisiyle ve Rec A’nın, polimerazın 3'-->5' ekzonükleaz (hata okuma ve çıkarma) aktivitesini inhibe etmesiyle translezyon replikasyon gerçekleşir. Hataya meyilli tamir sistemidir.
Çift Zincir Kırıklarının Tamiri
İyonize radyasyon, oksidatif hasar sonucu veya doğal oluşan DNA çift zincir kırıkları iki şekilde tamir edilir;
- Serbest uçların homolog olmayan şekilde bağlanması (non-homolog end joining) (NHEJ)
- Homolog rekombinasyon
NHEJ
Hızlı ve hataya meyilli bir sistemdir. Ku 70-Ku 80 kompleksleri DNA kırık uçlarına bağlanırlar. DNA bağımlı protein kinaz aktive olarak diğer proteinlerin hasar bölgesine gelmelerini sağlar. Bu protein komplekslerinin formasyonu DNA ligaz IV-XRCC4 kompleksinin kırık uçları bağlamasını sağlar.
Homolog rekombinasyon
RAD ve BRCA genleri tarafından yönlendirilir. MRE11-RAD50-NBS1 kompleksinin nükleaz aktivitesi ile kırık uçları degredasyona uğrar. RAD 52 proteini 3' uçlara bağlanır. RAD 51- BRCA 2 kompleksi, rekombinasyon oluşturmak üzere kardeş kromatid zincirinin hasar bölgesine invazyonunu sağlar. Bu zincir kalıp olarak kullanılarak sentez yapılır ve hasar onarılır (DNA polimeraz – DNA ligaz).
NHEJ tamir yolundaki hataların çeşitli kanserler ile ilişkili translokasyonlara neden olduğu gösterilmiştir. Burkitt lenfoma KML – Philadelphia kromozomu. Homolog rekombinasyonda görev alan BRCA1 ve BRCA2 genlerinde olan mutasyonlar ile meme ve rahim kanserleri arasında ilişki bulunmuştur.
Homolog olmayan rekombinasyon - NHEJ (Non-Homologous End-Joining)
Serbest iki DNA ucu tamir edilene kadar birarada tutulurlar (sinapsis).
- Kromatin yapısında değişmeler - Dna-Protein etkileşimleri - Protein-Protein etkileşimleri
ѕнσω мυѕт gσ ση ツ

 DNA Tamiri
DNA Tamiri

