Çekirdeğe en yakın enerji seviyesine dairesel hareket yapan elektron kararlıdır, ışık yaymaz. Elektron'a yeterli enerji verilirse elektron bulunduğu enerji seviyesinden daha yüksek enerji seviyesine sıçrar. Atom bu durumda kararsızdır. Kararlı hale gelmek için elektron tekrar eski enerji seviyesine dönerken almış olduğu enerji seviyesini eşit enerjide bir Foton (ışın taneciği) fırlatır. Atom bu şekilde ışıma yapar.
Bohr Atom Teorisi
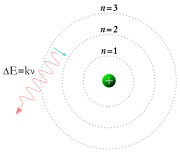
Buraya kadar anlatılan atom modellerinde, atomun çekirdeğinde, (+) yüklü proton ve yüksüz nötronların bulunduğu, çekirdeğin etrafında dairesel yörüngelerde elektronların dolaştığı ifade edildi. Bu elektronların çekirdek etrafında nasıl bir yörüngede dolaştığı, hız ve momentumlarının ne olduğu ile ilgili bir netice ortaya konmadı. Bohr ise atom teorisinde elektronların hareketini bu noktadan inceledi.
1913 yılında Neils Bohr, hidrojen atomunun spektrum çizgilerini ve Planck'ın kuvantum kuramını kullanarak Bohr kuramını ileri sürdü. Bu bilgiler ışığında Bohr postulatları şöyle özetlenebilir.
1. Bir atomdaki elektronlar çekirdekten belli uzaklıktaki yörüngelerde hareket eder ve bu yörüngelerdeki açısal momentumu h/2pi'nin tam katlarıdır. Her kararlı hâlin sabit bir enerjisi vardır.
2. Her hangi bir kararlı enerji seviyesinde elektron dairesel bir yörüngede (orbitalde) hareket eder. Bu yörüngelere enerji düzeyleri veya kabukları denir.
3. Elektron kararlı hâllerden birinde bulunurken atom ışık (radyasyon) yayınlamaz. Ancak, yüksek enerji düzeyinden daha düşük enerji düzeyine geçtiğinde, seviyeler arasındaki enerji farkına eşit bir ışık kuantı yayınlar. BuradaE = Eson-Eilk) bağıntısı geçerlidir.
4. Elektron hareketinin mümkün olduğu kararlı seviyeler, K, L, M, N, O gibi harflerle veya en düşük enerji düzeyi 1 olmak üzere, her enerji düzeyi pozitif bir tam sayı ile belirlenir ve genel olarak "n" İle gösterilir, (n: 1,2,3 .....¥)
Bugünkü bilgilerimize göre; Bohr kuramının, elektronların dairesel yörüngelerde hareket ettikleri, ifadesi yanlıştır.

 Bohr Atom Modeli
Bohr Atom Modeli



 nin katlarına bağlı değerler alacaktır.
nin katlarına bağlı değerler alacaktır.
 ;
; (4)
(4) (5)
(5)
