Ziyaretçi
Kovalent bağ,
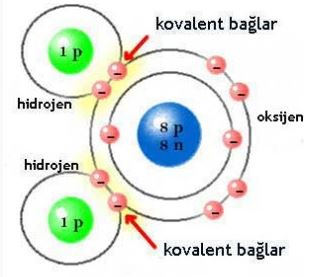
iki atom arasında, bir veya daha fazla elektronun paylaşılmasıyla karakterize edilen kimyasal bağ'ın bir tanımıdır. Genellikle bağ, ortaya çıkan molekülü bir arada tutan ortak çekim gücü olarak tanımlanabilir. Paylaşılan elektron ya da elektronlar, her iki çekirdek etrafında dolanacaklar, iki çekirdek arasındaki bölgede daha uzun süre bulundukları için bu bölgede (-) yüklü bir alan yaratacaklardır. Bu alan, her iki çekirdeğe bir çekme kuvveti uygulayarak bir bağ yaratır. Kovalent bağ, söz konusu atomların dış yörüngelerinin dolması ile meydana gelir. Bu tür bağlar, moleküller arası hidrojen bağından daima daha güçlü, iyonik bağ ile ise ya aynı güçte ya da daha güçlüdür.
Sponsorlu Bağlantılar
Bazı inorganik maddelerin -hidrojen, amonyak, klor, su ve azot molekülleri ile tüm organik maddelerin molekülleri kovalent bağ ile bir arada tutulmaktadır.
Kovalent bağ (iyonik ve metalik bağın tersine) yönlüdür; bağ açılarının etkileşimin gücü üzerinde etkisi büyüktür. Bu etkinin kaynağı, kovalent bağların, atomik yörüngelerin üst üste binmesiyle oluşmasından ileri gelir. Atomik yörüngeler (p, d, ve f orbitalleri) hepsi yönlü karakterde olup, bağlanma esnasında önemli ölçüde yöne bağlı etkileşime neden olurlar.
Kovalent bağ, genellikle benzer elektronegatifliğe sahip atomlar arasında gerçekleşir. Bu nedenle ametaller, daha kolaylıkla kovalent bağı tercih eder ve metaller de kolayca yerlerinden oynatılabilen elektronların daha serbestçe dolaşabildiği metalik bağ yaparlar. Ametallerde bir elektronun serbest kalması daha zordur, dolayısıyla benzer elektronegatifliğe sahip bir madde ile birleşme söz konusu olduğunda o elektronun paylaşılması tek seçenek haline gelir.
Tarihçe
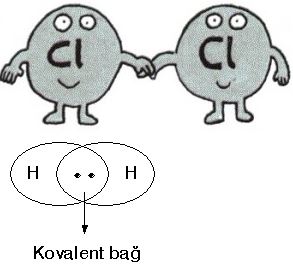
Kovalent bağ kavramı, ilk olarak 1916'da Gilbert N. Lewis tarafından, atomlar arasında elektron çiftlerinin paylaşılması şeklinde ortaya atılmıştır. Buna göre, dış yörüngedeki valans elektronları, atomik semboller etrafında birer nokta ile temsil edildiği Lewis notasyonu veya elektron nokta notasyonu ile gösterilmektedir. Atomlar arasındaki elektron çiftleri kovalent bağları göstermekte, çoklu çiftler ise çoklu bağlara karşı gelmektedir.
Her ne kadar, paylaşılmış elektron çiftleri fikri, kovalent bağlanmanın etkin ve miktarsal tanımını yapıyor olsa da, bu bağların doğasını anlamak ve basit moleküllerin yapısını ve özelliklerini tahmin edebilmek için kuantum mekaniği bilgisine ihtiyaç vardır. Kimyasal bağlanmanın, kuantum mekaniği açısından ilk başarılı açıklamasını 1927'de Walter Heitler ve Fritz London yapmıştır.
Bağ polaritesi
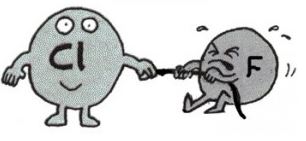
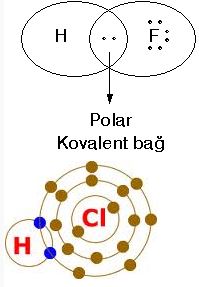
İki tür kovalent bağ vardır: polar ve polar olmayan (veya saf). Saf kovalent bağlar (ki genellikle çözünür değildirler, elektrik iletkenlikleri yoktur ve bireysel molekül formundadırlar) ve iyonik bağlar (çözünürdürler, ergimiş ve çözünmüş haldeyken elektrik iletirler, ve genellikle kristal formundadırlar) spektrumun iki ucunda yer alırlar ve farklı özelliklere sahiptirler. Polar kovalent bağlar ise ortada yer alır ve her ikisinin de özelliklerini gösterirler.
En son teori
Günümüzde valans bağ modeli, moleküler yörünge modeliyle desteklenmektedir. Bu modele göre, atomlar bir araya getirildikçe atomik yörüngeler, moleküler yörüngeler oluşturmak üzere etkileşirler. Kuantum mekaniği kullanılarak elektronik yapının, enerji seviyelerinin, bağ açılarının, ve bağ mesafelerinin yüksek bir hassasiyetle hesaplanması mümkündür.
Kovalent Bağ
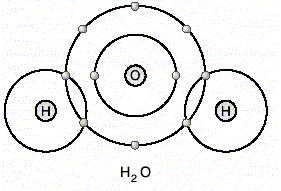
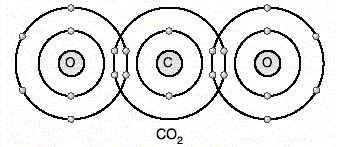
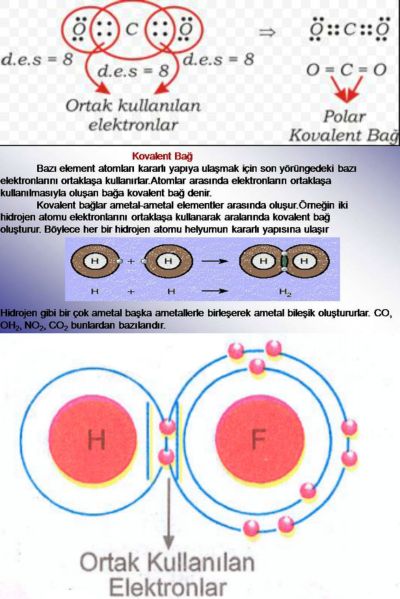
Ametal ametal atomları arasında elektron ortak kullanılması sonucu oluşan kimyasal bağa kovalent bağ denir.
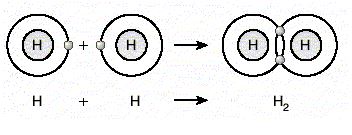
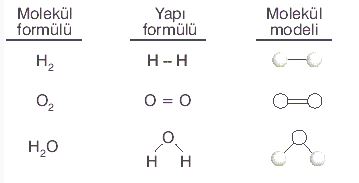
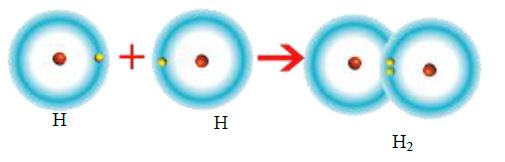
Tek elektron ortak kullanılması sonucu oluşan bağa tekli kovalent bağ denir. Hidrojen atomları arasında oluşan bağ tekli kovalent bağdır. (H-H)
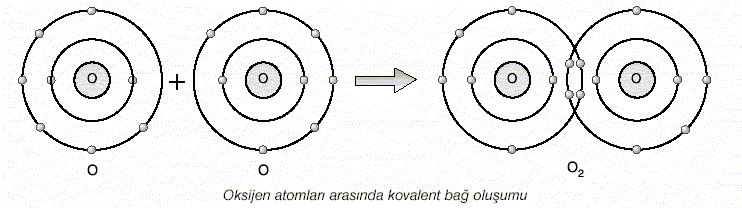
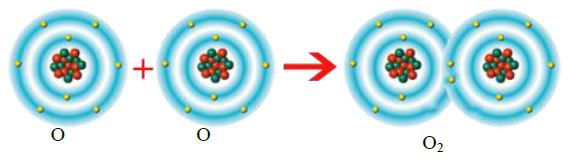
İki elektron ortaklaşması sonucu oluşan kovalent bağa ikili kovalent bağ denir. Oksijen atomları arasında oluşan bağ ikili
kovalent bağdır.(O=O)
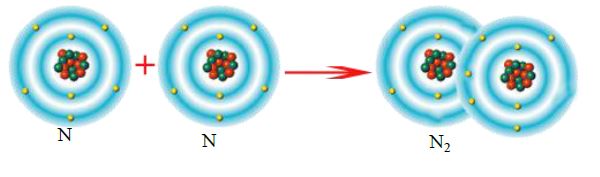
Üç elektron ortaklaşa kullanılması sonucu oluşan bağa üçlü kovalent bağ denir. Azot atomları arasında oluşan bağ üçlü
kovalent bağdır.(N≡N)
BAKINIZ Kimyasal Bağlar ve Hibritleşme
Son düzenleyen Safi; 26 Kasım 2016 06:02

 Kovalent Bağ
Kovalent Bağ