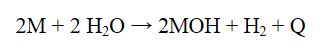Ziyaretçi
alkali metaller
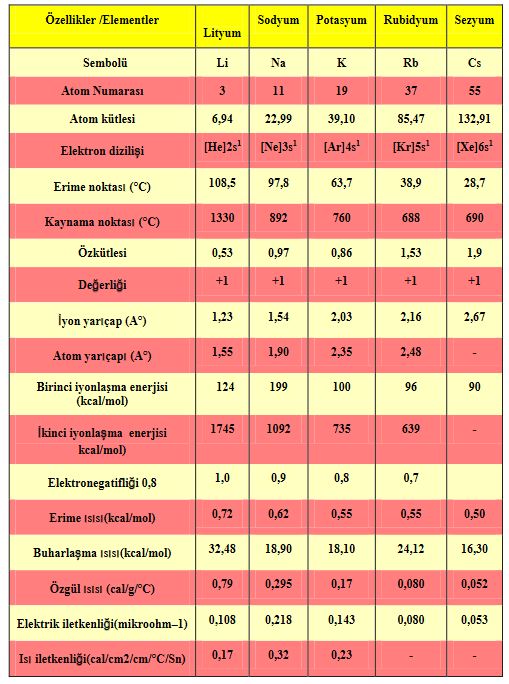
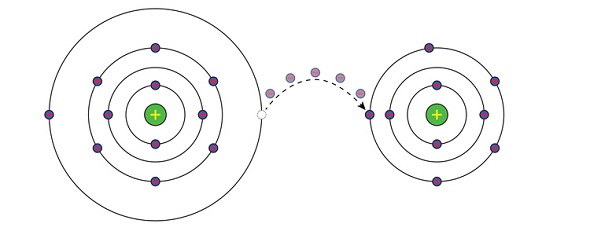
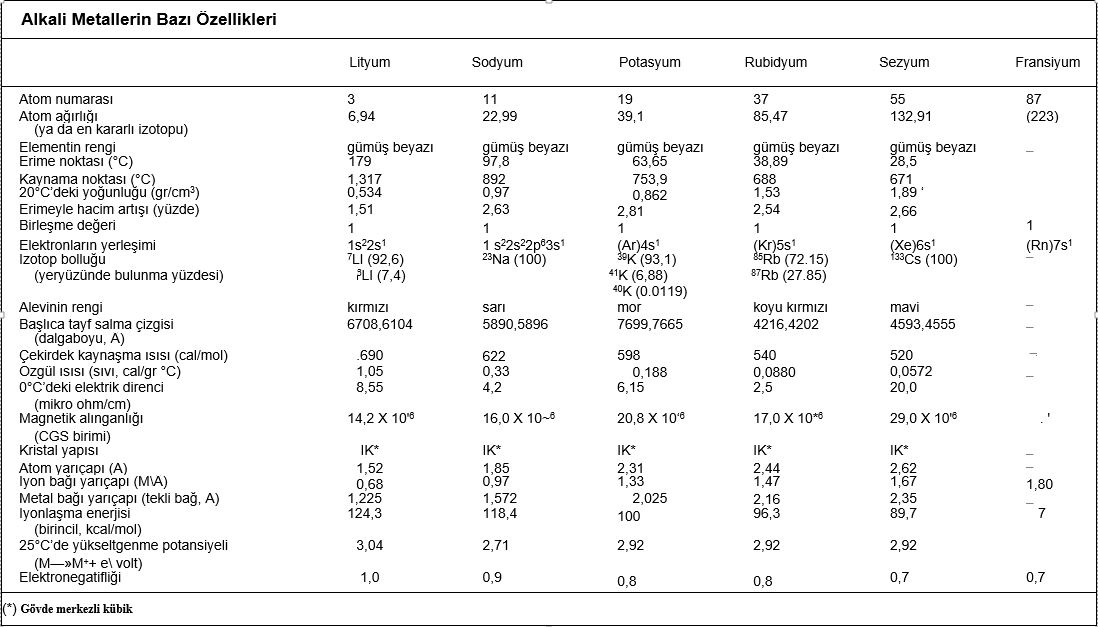
Alkali metaller periyodik cetvelin birinci sütununda bulunan bir değerlikli elektropozitif elementlerdir. Dış katmanlarında tek elektron vardır. Yoğunlukları düşük, kolayca eriyebilen, yumuşak katı maddelerdir. Çok elektropozitif olan alkali metaller ametallere, özellikle halojenlere ve oksijene karşı büyük ilgi gösterir. Dolayısıyla indirgen maddelerdir ve soğukta suyu bozundururlar. Hidroksitleri ise kuvvetli bazlardır; genellikle suda çözünen tuzları, renkli anyonlarla verdikleri tuzlar dışında, renksizdir.
Sponsorlu Bağlantılar
periyodik tablonun la grubunu oluşturan altı element: Artan atom numaralarına göre lityum (Li), sodyum (Na), potasyum (K), rubidyum (Rb), sezyum (Cs) ve fransiyum (Fr). Bu grubun üyeleri öbür elementlerle, özellikle oksijenle birleştiklerinde alkalileri (asitleri nötrleştirebilen güçlü bazları) oluşturduklarından, alkali metal adını alırlar.
Yerkabuğunun sırasıyla yüzde 2,6sını ve yüzde 2,4ünü oluşturan sodyum ve potasyum, alkali metallerin doğada en bol bulunan iki üyesidir. Öbür metallerin yerkabuğundaki oranı gittikçe azalır. Grubun son elementi olan doğal radyoaktif fransiyumun yerkabuğundaki toplam miktarının ancak 24.5 gr dolayında olduğu hesaplanmıştır. Alkali metaller çok etkin olduklarından, doğada serbest halde bulunmaz, +1 değerli oldukları basit ve suda çözünür iyon bileşiklerinin minerallerini oluştururlar. Halit ya da kayatuzu (NaCl) ve silvit (KC1) gibi bu basit bileşikler, alkali metallerin üretiminde hammadde kaynaklarıdır. Alkali metaller, mika ve zeolitler gibi daha karmaşık mineral yapılarına da katılır.
Metal olarak nitelendirilen elementler, ısı ve elektrik iletkenliklerinin yüksekliği, kesilme yüzeylerinin gümüş beyazı parlaklığında olması, tel halinde çekilebilme ve dövülebilme özellikleriyle ayırt edilir. Ia grubu, bu özellikleri en belirgin olan elementlerdir.
Alkali metallerin gövde (hacim) merkezli kübik kristalleri, atomlarının en dış yörüngelerindeki birer elektronlarını serbest bırakmalarından oluşan elektron denizi içindeki + 1 yüklü iyonlardan meydana gelmiştir. Elektrik ve ısı iletkenliklerinin yüksekliği, bu serbest ve hareketli elektronların taşıyıcı özelliklerinin sonucudur. Kesilme yüzeylerinin parlaklığı ise, yüzeye düşen ışık ışınlarının hareketli elektronlarla etkileşmesi sonucunda, titreşen elektronların her yöne doğru elektromagnetik ışıma salmasından doğar. Kristallerdeki metal iyonlarının yönlenmemiş kuvvetlerin etkisinde olması da kolayca kesilebilme, dövülebilme ve çekilebilme özelliklerine yol açar. Bu gruptaki elementler bıçakla kesilebilecek kadar yumuşaktır.
Alkali metallerin birincil iyonlaşma enerjileri (bir atomdan bir elektron koparabilmek için verilmesi gereken en küçük enerji miktarı) öbür elementlerin iyonlaşma enerjilerinden daha küçüktür ve lityumdan sezyuma doğru giderek azalır. Elektron yakalama eğiliminin bir ölçüsü olan elektronegatiflikleri de aynı sırayı izleyerek azalır. Elektronegatifliği en küçük olan element sezyumdur. Alkali metallerin erime ve kaynama dereceleri, cıva ve gazlar dışında, tüm elementlerden daha düşüktür.; bu da kristal örgülerinin gevşek yapıda olmasından ileri gelir. Kimyasal etkinlikleri çok yüksek olan alkali metaller, metal olmayan elementlerle kolayca bileşik oluştururlar. Havadaki oksijen ve su buharıyla bile hızla tepkimeye girdiklerinden, laboratuvarda bu elementleri gazyağı gibi hidrokarbonlar içinde saklamak gerekir.
Alkali metaller oksijenle birleştiğinde basit oksitleri (örn. Lİ2O), peroksitleri (örn. Na2O2) ve süperoksitleri (örn. KO2 ve RbCh) verir, suyla birleşerek de hidroksitleri oluşturur. Bu tepkimelerin tümü ısıveren (eksotermik) türdendir ve kimi koşullarda patlamalara yol açar. Yükseltgenme potansiyelleri yüksek olan alkali metallerin hepsi de güçlü birer indirgendir; grup Va, Via ve Vlla elementleriyle de ısıveren, şiddetli tepkimelere girerek bileşikler oluşturur.
Alkali metalleri doğadaki basit tuzlarından elde etmek için uygulanan temel yöntem, eritilmiş tuzlarının ya da hidroksitlerinin elektrikle aynştınlmasıdır. Elektroüz sonunda, alkali metaller katotta toplanır.
Alkali metallerin sanayide yaygın bir kullanım alanı vardır. Nükleer reaktörlerde ısı aktarımı için, ısı iletkenlikleri yüksek olan sıvı sodyum ve sıvı lityum kullanılır. Uzay araçlarında yakıt olarak kullanılan sezyum tuzlanndan aynca ışık çoğaltıcı lambalarda, kızılötesi lambalarda ve spektrofotometrelerde de yararlanılır. Potasyumun yapay gübre üretimindeki önemi büyüktür. Aynca çeşitli alaşımlara da alkali metaller katılmaktadır.
kaynak: Ana Britannica
Son düzenleyen Safi; 27 Eylül 2016 02:01

 Alkali Metaller
Alkali Metaller