KARBON ATOMU
Karbon, canlılar için en hayati elementtir. Çünkü bütün canlı maddeler karbon bileşiklerinden oluşmuşlardır. Bizlerin varlığı için bu kadar önemli olan karbon atomunun özelliklerini sayfalarca yazsak bitiremeyiz, nitekim kimya bilimi de henüz bu özelliklerin tümünü keşfedebilmiş değildir. Biz burada karbonun sadece çok önemli birkaç özelliğinden bahsedeceğiz.
Hücre zarından ağaç kabuğuna, göz merceğinden bir geyiğin boynuzlarına, yumurta beyazından yılan zehirine kadar son derece farklı organik yapıların hepsi, karbon temelli bileşiklerden oluşur. Karbon, hidrojen, oksijen ve azot atomlarıyla çok farklı geometrik şekil ve sıralamalarda birleşerek, son derece farklı maddeler meydana getirir. Peki ama karbonun yaklaşık olarak 1.7 milyon kadar bileşik yapabilmesinin sebebi nedir?
Karbonun en önemli özelliklerinden birisi, birbiri ardınca dizilerek çok kolay zincir oluşturabilmesidir. En kısa karbon zinciri 2 karbon atomundan oluşur. En uzun zincirin kaç karbon atomundan oluştuğu konusunda ise kesin bir rakam verilememekle birlikte, yaklaşık olarak 70 halkalı bir zincirden bahsedilebilir. Karbon atomundan sonra en uzun zincir oluşturabilen atomun, 6 halka ile silisyum atomu olduğunu düşünürsek, karbon atomundaki olağanüstü durum daha iyi fark edilebilir.
Karbonun bu kadar çok halkalı zincir yapabilmesinin sebebi, zincirlerinin sadece düz çizgi şeklinde olmamasıdır. Zincirler dallar halinde de olabilirler, çokgenler de oluşturabilirler. Bu noktada, zincirin şeklinin önemi çok büyüktür. İki karbon bileşiğinde, karbon atomu sayısı aynı fakat bileşiklerin zincir biçimleri farklıysa, ortaya 2 ayrı madde çıkmaktadır. Ve böylece karbon atomunun, yukarıda saydığımız özellikleri ile, canlı hayatı için çok büyük önemi olan moleküller yaratılmaktadır.
Karbon bileşiklerinin bazıları sadece birkaç atomdan oluşur. Bazıları ise binlerce hatta milyonlarca atomdan meydana gelir. Bütün elementler içinde sadece karbon elementinin atomları bu denli uzun ve kalıcı bileşikler oluşturabilir. Ünlü kimyager David Burnie Life adlı kitabında bu elementin özelliğini şöyle ifade eder:
"Karbon, çok olağan dışı bir elementtir... Karbon ve onun bu olağan dışı özellikleri olmasa, Dünya'da yaşam olması mümkün gözükmemektedir."
ÜÇ BENZER MOLEKÜL
SONUÇ: ÜÇ ÇOK FARKLI MADDE
Moleküller arasındaki birkaç atomluk bir farklılık bile, çok değişik sonuçlar oluşturur. Örneğin şimdi vereceğimiz iki moleküle dikkatle bakın. İkisi de birbirine çok benziyor, ancak karbon ve hidrojen sayılarında çok ufak farklılıklar var. Ama sonuç iki zıt madde oluşturmaya yetiyor: Bu moleküller nedir, bir tahminde bulunabiliyor musunuz? Hemen söyleyelim: Birincisi östrojen, ikincisi ise testesteron'dur. Yani biri kadınlık, diğeri de erkeklik hormonudur. Birkaç atomluk bir fark bile, hayret verici biçimde, cinsiyet farklılıklarına sebep olmaktadır.
Şimdi, vereceğimiz formüle bir bakın: Yukarıdaki molekül, östrojen ve testesteron hormonlaı moleküllerine ne kadar da benziyor, değil mi? Peki, bu molekül nedir? Başka bir hormon mu? Hemen cevaplayalım: Bu molekül şeker molekülüdür.
Aynı çeşit elementlerden oluşan bu üç molekül örneğinde, atom sayılarndaki farklılığın, ne derece farklı maddeler oluşturabildiği çok net olarak görülür. Bir tarafta cinsiyet oluşturan hormonlar, bir diğer tafata da temel besin maddesi şeker var.
İngiliz kimyager Nevil Sidgwickde, Chemical Elements and Their Compounds (Kimyasal Elementler ve Bunların Bileşikleri) adlı eserinde karbonun canlılar için ne denli önemli olduğunu şöyle vurgular:
Karbon, yapabildiği bileşiklerin sayısı ve çeşitliliği yönünden, diğer elementlerden tamamen farklı, özgün bir yapıdadır. Şimdiye dek karbonun yarım milyonun üzerinde farklı bileşiği ayrılmış ve tanımlanmıştır. Ama bu bile karbonun güçleri hakkında çok yetersiz bir bilgi verir, çünkü karbon tüm canlı maddelerin temelini oluşturur.
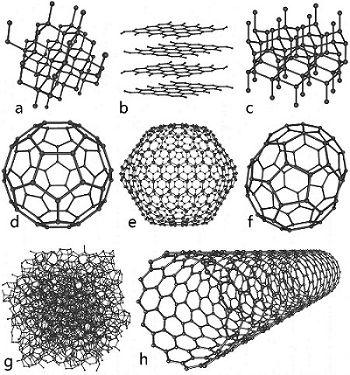
Çok değerli bir taş parçası olan elmas, doğada genelde grafit halinde bulunan kabronun bir türevidir. Karbonun sadece hidrojen ile kurduğu farklı bağlar, "hidrokarbonlar" olarak bilinen büyük bir aileyi meydana getirir. Bu aile içinde; doğal gaz, sıvı petrol, gaz yağı, kerosen ve çeşitli makina yağları vardır. Etilen ve propilen olarak bilinen hidrokarbonlar ise petrokimya endüstrisinin temelidir. Başka hidrokarbonlar da benzen, toluen ve turpentin gibi bileşikler meydana getirir. Giysilerimizi güvelenmekten koruması için dolaplara konan naftalin ise bir başka tür hidrokarbondur. Klor veya florla birleşen hidrokarbonlar ise anestezi maddeleri, yangın söndürücüler ve buzdolaplarında kullanılan freonlar gibi farklı maddeleri oluşturur.
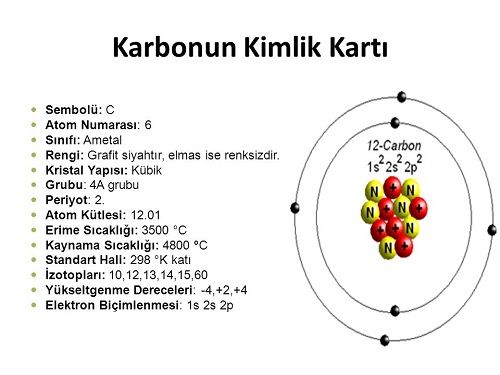
Yukarıdaki sözünde kimyager Sidwickin de belirttiği gibi içinde sadece 6 proton, 6 nötron ve 6 elektron bulunduran bu atomun gücünü tam anlayabilme konusunda insan aklı yetersiz kalmaktadır.
YAN YANA GELEN HER ATOM HEMEN REAKSİYONA GİRSEYDİ NE OLURDU?
Az önce tüm evrenin 109 farklı elementin atomlarının birbirleriyle reaksiyona girmeleri sonucu oluştuğunu söylemiştik. Burada, üzerinde dikkatle durulması gereken bir nokta vardır; o da, tepkimenin oluşabilmesi için çok önemli bir koşulun gerçekleşmesi gerektiğidir. Örneğin, oksijenle hidrojen her bir araya geldiğinde su oluşmaz. Ya da demir havayla temas eder-etmez hemen paslanmaz. Eğer öyle olsaydı, katı ve parlak bir metal olan demir, birkaç dakika içinde yumuşak bir toz olan demir okside dönüşür, yeryüzünde metal diye bir madde kalmaz ve dünyanın düzeni bozulurdu. Belirli bir mesafede yan yana gelen atomlar belirli koşullar oluşmadan hemen birleşseydi farklı iki maddenin atomları hemen tepkimeye girerlerdi. Böyle bir durumda ise, koltuğa oturmanız bile mümkün olmazdı. Çünkü koltuğu oluşturan atomlarla vücudunuzu oluşturan atomlar hemen tepkimeye girer ve koltuk-insan arası bir varlıkolurdunuz. Şüphesiz ki, böyle bir dünyada canlı hayatının varlığı söz konusu bile olamazdı. Acaba, böyle bir sonucun yaşanması nasıl engellenmektedir? Bir örnekle açıklamak gerekirse, hidrojen ve oksijen molekülleri oda sıcaklığında çok yavaş tepkimeye girerler, yani "su" oda sıcaklığında çok yavaş oluşur. Ancak, ortamdaki sıcaklık arttığında moleküllerin enerjileri de artar ve tepkime hızlanır, yani su daha hızlı oluşur. Moleküllerin tepkimeye girebilmeleri için gereken minimum enerji miktarı, "aktifleşme enerjisi" adı verilen enerji düzeyidir. Su örneğinde görüldüğü gibi, hidrojen ve oksijen moleküllerinin tepkimeye girip suyu oluşturabilmeleri için, enerjilerinin aktifleşme enerjisinden yüksek olması gerekmektedir. Düşünün ki, yeryüzündeki sıcaklık biraz daha yüksek olsaydı, atomlar çok çabuk tepkimeye girerdi ve doğadaki denge de bozulurdu. Ancak tersi olsaydı, yani yeryüzündeki sıcaklık daha düşük olsaydı, bu durumda da atomlar tepkimeye girmekte çok ağır kalacaklar ve yine doğadaki dengeler bozulacaktı. Bundan da anlaşıldığı gibi Dünyanın Güneş'e uzaklığı tam olarak canlı hayatına uygun olacak bir noktadadır. Elbette ki canlılık için gereken hassas dengeler bununla kısıtlı değildir.
Dünyanın eksenindeki eğim, kütlesi, yüzey genişliği, atmosferindeki gazların oranı, uydusu Ay ile arasındaki mesafe ve daha birçok faktör, sadece ve sadece şu andaki değerleriyle mevcut olduğu takdirde canlıların hayatta kalması mümkün olmaktadır. Bu noktada ortaya çıkan, tüm bu faktörlerin birbiri ardınca tesadüflerle oluşamayacağı, hepsinin de canlıların tüm özelliklerini bilen ve üstün bir kudret sahibi olan Allah tarafından var edildikleri gerçeğidir. Kuşkusuz bilimin bu noktada verdiği cevap, gözlemlediği fizik kurallarına bir isim takmaktan ibarettir.
En başta da belirttiğimiz gibi bu tür olaylarda ne, nasıl, ne şekilde gibi soruların pek bir anlamı yoktur. Bu sorularla ulaşabildiğimiz yalnızca, zaten var olan bir kuralın detaylarıdır. Asıl sorulması gereken soru, bu kuralın neden ve kim tarafından var edildiğidir. Bu sorunun cevabı ise maddeci inançlarına körü körüne bağlı olan bilim adamları açısından yine bir muammadır. İşte materyalistlerin cevap veremediği bu noktada, aklı ve vicdanıyla bakan bir göz için durum son derece açıktır: Hiçbir şekilde tesadüflerle açıklanamayacak olan evrendeki kusursuz dengeler, üstün bir aklın ve iradenin dilemesi sonucu gerçekleşmiştir. "Şüphesiz, Allah her şeyin hesabını tam olarak yapandır" (Nisa Suresi, 86) ayetinde de belirtildiği gibi Allah her şeyi çok hassas bir hesap, düzen ve denge üzerine yaratmıştır.
Moleküller Arası Bağlar: Zayıf Bağlar
Proteinler vücudumuzdaki çok önemli görevlerini yerine getirmek için üç boyutlu özel bir yapıya sahip olmalıdırlar. Bu yapı, moleküller arasındaki zayıf bağlarla meydana gelir.
Atomları birbirine bağlayan bağlar bu bağlara nisbeten çok daha kuvvetlidirler. Bu bağlar sayesinde milyonlarca hatta milyarlarca çeşit molekül oluşabilir. Peki maddeyi oluşturmak üzere moleküller nasıl birleşirler? Moleküller oluştuktan sonra bir dengeye sahip oldukları için artık moleküller arasında elektron alışverişi olmaz. Peki onları bir arada tutan şey nedir? Bu soruyu cevaplamaya çalışan kimyacılar farklı teoriler üretmeye başlamışlardır. Yapılan araştırmalar moleküllerin içlerindeki atomların özelliklerine göre farklı şekillerde birleşebildiklerini ortaya çıkarmıştır.
Bu bağlar canlıların kimyası olarak bilinen organik kimya için çok önemlidir. Çünkü canlılığı meydana getiren en önemli moleküller bu bağı kurma özellikleri sayesinde ortaya çıkabilir. Protein örneğini ele alalım. Canlılığın temel yapı taşı olan proteinlerin, karmaşık üç boyutlu şekilleri bu bağlar sayesinde meydana gelir. Yani canlılığın oluşması için atomlar arasındaki güçlü kimyasal bağ kadar moleküller arası zayıf kimyasal bağ da var olmalıdır. Elbette ki bu bağın kuvveti de belli bir ölçüye sahip olmalıdır.
Protein örneğinden devam edebiliriz. Proteinler aminoasit adlı moleküllerin birleşmesinden oluşan çok daha büyük moleküllerdir. Aminoasitleri meydana getiren atomlar kovalent bağ ile birleşirler. Zayıf bağlar da oluşan bu aminoasitleri üç boyutlu dizilimi elde edecek şekilde birbirine bağlar. Proteinler ancak bu üç boyutlu şekilleriyle var oldukları takdirde canlı organizmalarda fonksiyon gösterebilirler. Bu yüzden eğer bu bağlar olmasaydı proteinler ve dolayısıyla canlılık var olamazdı.
Bir çeşit zayıf bağ olan "hidrojen" bağları da hayatımızda çok önem taşıyan maddelerin baş aktörleridir. Örneğin yaşamın temeli olan "su"yu oluşturan moleküller hidrojen bağlarıyla bağlıdırlar.


 Elementler - Karbon
Elementler - Karbon