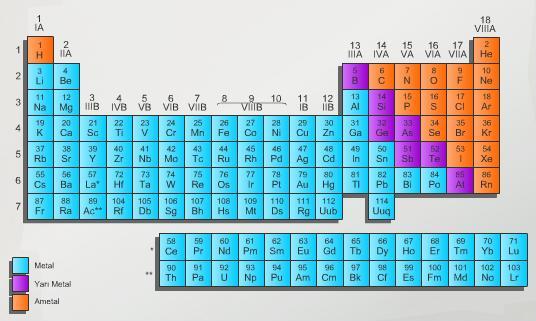
Periyodik Cetvel ,elementlerin sembolleriyle gösterildiği ve özellikleri hakkında bilgi veren cetveldir
Periyotlar cetveli ilk defa dimitri Mendelev tarafından yapılmıştır(elementleri atom ağırlıkları=Kütlelerine göre düzenlemiştir )
Periyotlar cetveli yatay ve düşey sıralardan oluşmuştur
P E R İ Y O T - Periyotlar cetvelindeki yatay sıralardır
- Elementler atom numarası en küçük ten en büyüğe doğru ( soldan sağa ) sıralanırlar
- Periyot numarası enerji seviyesini = yörünge sayısını gösterir
- 7 periyot bulunur
- PERİYOTLAR CETVELİNDE SOLDAN SAĞA DOĞRU GİDİLDİKCE
1-Atom numarası artar
2-Kütle numarası artar
3-Metalik özellik azalır
4-Ametalik özellik artar
5-Elektron verme özelliği azalır
6-Elektron alma özelliği artar
7-Atom çapı küçülür
8-Asitlik özelliği artar
9-İyonlaşma enerjisi büyür
10-Elektro negatiflik büyür
LANTANİTLER :Atom numarası 58 71 olan elementler ( 6 periyotta )
AKTİNİTLER :Atom numarası 89 103 olan elementler ( 7 periyotta )
1. Periyotta 2 element
2 . 8
3 . 8
4 . 18
5 . 18
6 . 32
7 . 23 tamamlanmamıştır
G R U P
Periyotlar cetvelindeki düşey sıralardır
Elementler gruplara ortak kimyasal özelliklerine göre sıralanmıştır
18 tane grup vardır 8 tane A grubu
8 tane B grubu ( 8B grubu 3 gruptan oluşur ) )
1A Grubu ALKALİ METALLER
2A TOPRAK ALKALİ METALLER
3A METALLER
7A HALOJENLER
8A SOYGAZLAR
1A , 2A , ,3A , grubunda
METALLER
4A , 5A , 6A , 7A grubunda
AMETALLER
8A grubunda
SOYGAZLAR
PERİYOTLAR CETVLİNDE YUKARIDAN AŞAGIYA DOĞRU İNİLDİKÇE
1-Atom numarası artar
2-Kütle numarası artar
3-Metalik özellik artar
4-Ametalik özellik azalır
5-Elektron verme isteği artar
6-Elektron alma isteği azalır
7-Atom çapı büyür
8-Bazlık özelliği artar
Her grup ve periyot boyunca elementlerin özellikleri genellikle sistematik bir biçimde değişiklik gösterirler.
Aynı grupta olan elementler sertlik , parlaklık , iletkenlik , elektron alma veya verme yatkınlıları bakımından birbirine benzerdir.
M E T A L L E R
1- Katıdırlar ( Civa = Hg hariç )
2- Yüzeyleri parlaktır
3- Isı ve elektriği iyi iletirler
4- Tel ve levha haline gelebilirler
5- Tek atomludurlar ( atomik yapılıdırlar )
6- Kendi aralarında bileşik yapmazlar
7- Kendi aralarında alaşım yaparlar
8- Elektron verme özelliğindedirler ( katyon = +)
9- Ametallerle iyonik bileşik yaparlar
10- Canlıların yapısında çok az bulunur
11- Erime-kaynama noktaları yüksektir
12- 1A,2A,3A grubunda bulunurlar
13- Sulu çözeltileri BAZ özelliği taşır
Metaller ;
periyodik tablonun sol tarafında bulunurlar.
genellikle dayanıklı ağır , parlak maddeler olarak tanımlanır.
ısı ve elektriği iyi iletirler.
dövülerek tel ve levha haline getirilebilirler.
üzerine vurulduğunda çınlama sesi duyulur.
A M E T A L L E R
1 katı, sıvı, gaz halindedirler
( İyot=I , karbon=C , fosfor = P , kükürt = S katı )
( Brom= Br sıvı )
( Azot=N , Oksijen=O, Hidrojen=H klor=Cl gaz )
2 Yüzeyleri mattır
3- Isı ve elektriği iyi iletmezler
4- Tel ve levha haline gelemezler
5- İki ve daha fazla atomludurlar ( molekül yapılı
6- Kendi aralarında bileşik yaparlar
7- Kendi aralarında alaşım yapmazlar
8- Elektron alma özelliğindedirler ( Anyon= )
9- Kendi aralarında Kovalent bileşik yaparlar
10- Canlıların yapısında bolca bulunurlar
11- Erime-kaynama noktaları düşüktür
12- 4A,5A,6A,7A grubunda bulunurlar
13- Sulu çözeltileri ASİT özelliği taşır
Ametaller ;
periyodik tablonun sağ tarafında bulunurlar.
genellikle parlak olmayan ( mat ) maddeler olarak tanımlanır.
ısı ve elektriği iyi iletmez.
dövülerek tel ve levha haline getirilemezler kırılgan yapıdadırlar.
ametaller ve bileşikleri değişik alanlarda kullanılırlar.
Örnek : Klor ve bileşikleri ; - Kuru temizlemede kirlerin çözünmesinde,
- Yüzme havuzlarının bakterilerden arındırılmasında,
- Tuvalet temizliğinde ,
- Hidroklorik asit yapımında ,
- Tarımda yabani otların temizlenmesinde,
- İçme sularının bakterilerden arındırılmasında,
- Antiseptik ve dezenfektan olarak kullanılan ilaçların yapımında
Y A R I M E T A L L E R
Hem metallerin hem de ametallerin özelliklerini bir arada taşıyan elementlere denir.
Yarı metaller bazı fiziksel özellikleri ve görünüşleri yönünden metallere , kimyasal özellikleri bakımından daha çok ametallere benzerler.
Yarı metaller sınıfında 8 element bulunur
Bor = B Silisyum = Si Germanyum = Ge Arsenik = As
Antimon = Sb Tellür = Te Polanyum = Po Astanit = At
1 Parlak veye mat olabilirler
2 Elektrik ve ısıyı ametallerden daha iyi metallerden daha az iletirler.
3 İşlenebilirler ( tel ve levha haline getirilebilirler )
4 Kırılgan değildirler.
Yarı metaller;
elektronik devre elemanlarında ,
değişik alanlarda ( mikroskop mercekleri , projektörlerde ) kullanılır.
S O Y G A Z L A R
1- Doğada gaz halinde bulunurlar
2- Kararlı yapıdadırlar
3- Bileşik oluşturmazlar
4- Tek atomludurlar
5- Erime kaynama noktaları düşüktür
6- Periyodik tabloda 8A grubunda yer alırlar
Helyum = He Argon = Ar Ksenon = Xe
Neon = Ne Kripton = Kr Radon = Rn
BAKINIZ Periyodik Tablo ve Tarihçesi