Niels Henrik David Bohr (7 Ekim 1885, Kopenhag - 18 Kasım 1962, Kopenhag), Danimarkalı ünlü fizikçi.
Kuantum kuramının atom yapısının belirlenmesinde ilk kez kendi adıyla anılan atom modelini oluşturdu. Kuantum fiziğinin gelişmesinde 50 yıla yakın bir süre öncü rol oynadı. Ayrıca atom çekirdeğinin "sıvı damlacığı modeli"ni geliştirdi.
Yaşamı
Söylentiye göre, Danimarka halkının övünç duyduğu dört şey vardır: Gemi endüstrisi, süt ürünleri, peri masalları yazarı Hans Christian Andersen ve fizik bilgini Niels Bohr. Bohr, bilgin kişiliği ve insancıl davranışlarıyla, büyük hayaller peşinde koşan gençlere örnek ve esin kaynağı olan bir öncüydü. O, ne Rutherford gibi dış görünümüyle ürkütücü ne de Einstein gibi "arabaya tek başına koşulan at" idi.
Daha önce Rutherford'un olağanüstü yeteneğini farketmiş olan Thomson, nedense Danimarkalı gence sıradan biri gözüyle bakıyordu. Tartışmalı bir toplantıda Bohr'un ileri sürdüğü bir çözümü irdelemeden yanlış diye geri çevirir, daha sonra aynı çözümü kendisi dile getirir. Bu olayı içine sindiremeyen Bohr yeni arayışlar içine girer.
Bu sırada bilim dünyasının parlayan yıldızı Rutherford'tur. Katıldığı bir konferansında Rutherford'un coşkusuyla büyülenen Bohr, Cavendish'i bırakır, Manchester'de onun ekibine katılır. Rutherford deneyciydi, Bohr ise kuramsal araştırmaya yönelikti. Ama iki bilimadamı arasındaki ilişki ömür boyu süren bir dostluğa dönüştü. Öyle ki, Bohr biricik oğluna hocanın adını (Ernest') verdi. Oysa, bursunun tükenmesi nedeniyle Manchester'de yalnızca altı ay kalabilmiştir.
Bohr oluşturduğu atomun kuvantum kuramını yayımlamadan önce Rutherford'un incelemesine sunmuştu. Rutherford her şeyde basitliği arayan titiz bir kişiydi. Bohr'un yazısı karmaşık, uzun ve gereksiz yinelemelerle doluydu. Rutherford düzeltilmesini gerekli gördüğü noktalara değindikten sonra, "çalışman gerçekten ilginç, kuramının atoma ilişkin pek çok probleme çözüm getirici nitelikte olduğunu söyleyebilirim," diyerek genç bilimadamını yüreklendirmişti.


Bohr ve Einstein (1925)
Bohr'un kuramı 1913'te İngiltere'de yayımlanır. Ne var ki, bilimadamlarının bir bölümünün tepkisi olumsuzdur. Onlara göre ortaya konan, bir kuram olmaktan çok rakamlarla oluşturulmuş bir düzenlemeydi. Oysa, başta Einstein olmak üzere kimi bilimadamları, çalışmanın büyük bir buluş olduğunu farketmişlerdi. Kuramın, spektroskopi biliminin atomik temelini kurduğu çok geçmeden anlaşılır. Bir yandan da kuramı doğrulayan deneysel kanıtlar birikmeye başlar.
Kopenhag Teorik Fizik Enstitüsü başkanlığına getirilen Bohr, 1922'de Nobel Ödülü'nü alır. Artık kısaca "Bohr Enstitüsü" diye anılmaya başlayan Enstitü'ye dünyanın pek çok ülkesinden genç fizikçilerin akını başlar. Gelenler arasında Heisenberg, Pauli, Gamow, Landau gibi sonradan ün kazanan genç araştırmacılar da vardır. Kısa sürede dünyanın en canlı bilim merkezine dönüşen Enstitü bir grup üstün yetenekli genç için bulunmaz bir eğitim ortamı olmuştu.
Bohr çalışma yaşamında sergilediği istenç gücünün yanısıra neşe ve mizahıyla gönülleri fethetmesini de biliyordu. Bir teori üzerine tartışırken, sözlerini şöyle bağlamıştı: "Bu teorinin çılgınca bir şey olduğunu biliyoruz. Ama ayrıldığımız nokta, teorinin, doğru olması için yeterince çılgınca olup olmadığıdır."
Son önemli çalışmasını, 1939'da yaptı. Yeni keşfedilmiş olan çekirdek bölünmesinin neden bazı çekirdeklerde olup diğerlerinde olmadığını açıklamak için, bir büyük çekirdek ile bir sıvı damlası arasındaki benzerliği kullanmıştı. II. Dünya Savaşı sırasında Bohr, New Mexico'daki Los Alamos'ta (ABD) atom bombasının geliştirilmesine katkıda bulundu. Savaştan sonra Kopenhag'a döndü ve burada 1962'de öldü.
Çalışmaları
Bohr'un bilimde ilgi odağı atom çekirdeğine ilişkin deney sonuçları değil, kuramsal bir sorundu: Bir elektrik birimi olan elektronun atom kapsamındaki davranışının bilinen fizik yasalarına ters düşmesinin nedeni ne olabilirdi? Normal olarak, pozitif yüklü çekirdeğin çevresinde dönen negatif yüklü elektronun, devinim sürecinde, elektromanyetik radyasyon salarak enerji yitirmesi ve çekirdeğe gömülmesi; atomun çökmesi gerekirdi.
Max Planck'ın kara-cisim radyasyon katastrofuna benzer bir katastrof! Planck karşılaştığı sorunu 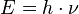 denklemiyle açıklamıştı. Bu sorun da belki kuvantum kavramına başvurularak açıklanabilirdi. Hiç değilse Niels Bohr böyle düşünmekteydi.
denklemiyle açıklamıştı. Bu sorun da belki kuvantum kavramına başvurularak açıklanabilirdi. Hiç değilse Niels Bohr böyle düşünmekteydi.
Sorun, "spektrum analizi" ya da "spektroskopi" denen konu kapsamındaydı. Bohr "çizgi spektrası"na ilişkin bir formülden nedense habersizdi. Bohr, formülü bir meslekdaşının yardımıyla sonunda öğrenir. Okul ders kitaplarına bile geçen formülün, Bohr'un gözünden kaçmış olması ilginçtir.
Bir aritmetik oyununu andıran işlemi 1885'te Balmer adında İsviçreli bir lise öğretmeni bulmuştu. Buna göre, örneğin, hidrojen spektrumundaki kırmızı çizginin frekansını saptamak için, 3'ün karesi alınır, l bu sayıya bölünür, çıkan bölüm 32.903.640.000.000.000 sayısıyla çarpılır. Yeşil çizginin frekansı için işleme 4, mor çizginin frekansı için 5'le başlanır. Balmer, formülünü ortaya koyduğunda hidrojen spektrumunda yalnızca üç çizgi biliniyordu. Sonra bulunan çizgiler için işleme 6, 7, 8, ... sayılarıyla başlanır.
Bohr 1912'de Kopenhag'a döndüğünde çözüm aradığı problemi birlikte getirmişti. Atomun yapısını açıklamaya çalışan Bohr için Balmer formülü niçin önemliydi? Yanıt basittir: Bohr, Planck sabiti h'yi kullanarak bu formülle enerji kuvantlarından oluşan spektrumu açıklayabileceğini görmüştü.
Başka bir deyişle, formülün sağladığı ipucuyla atomların normalde neden enerji salmadığı, elektronların neden hız kaybedip çekirdeğe gömülmediği açıklık kazanmaktaydı. Bohr'un o zaman bilinen fizikle bağdaşmaz görünen görüşü başlıca dört nokta içeriyordu:
- Elektron, olası tüm yörüngelerde değil, yalnız enerjisi Planck sabitiyle bir tam sayının çarpımına orantılı olan yörüngelerde devinir.
- Elektron, enerji değişimiyle kuvantum yörüngelerinin birinden öbürüne geçebilir; ancak çekirdeğe en içteki yörüngeden daha fazla yaklaşamaz.
- Bir kuvantum yörüngede devinen elektron bir iç yörüngeye düşmedikçe radyasyon salmaz. Bu düşüş belli bir miktarda ışık enerjisi üretmekle kalır. Üretilen enerjinin frekansı iki yörünge arasındaki enerji farkının Planck sabitine bölünmesine eşittir:
Frekans = Enerji Kaybı / Planck Sabiti - Bir elektronun taşıyabileceği enerjiler sınırlıdır ve bu kesintili enerjiler atomun kesintili çizgi spektrumunda yansır.
Atom yapısının anahtarını, salınan ışığın spektrumunda arayan bu görüşün, birtakım gözlemlere açıklık getirmekle birlikte, doğruluğu kuşkuluydu. Aynı gözlemler başka hipotezlerle de açıklanabilirdi. Ayrıca, elektronların Bohr'un öngördüğü biçimde davrandığını gösteren somut kanıtlar da ortada yoktu henüz. Kaldı ki, kuvantum yörüngeleri düşüncesi olgusal dayanaktan yoksundu.
Bohr'un hipotezi öncelikle hidrojen spektrumunu açıklamaya yönelikti. Gerçi olgusal olarak henüz yoklanmamıştı, ama hipotezin Balmer formülünde yer alan sayının anlamını belirginleştirmesi, geçerliliği açısından önemli bir avantaj sağlamaktaydı. Ayrıca, Bohr'un değişik kuvantum yörüngelerinin enerjilerini veren formülü, önerdiği atom kuramına istenen belirginliği kazandırır.