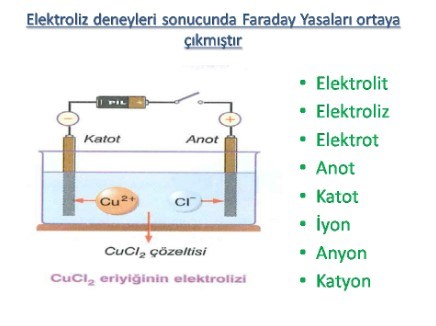
elektroliz
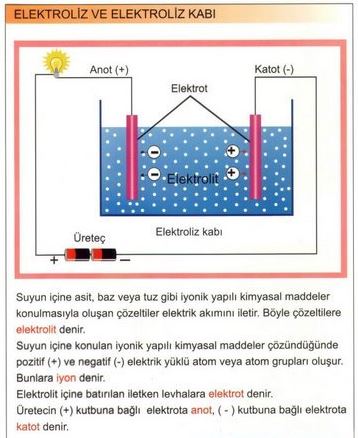
ELEKTRİKLE AYRİŞTİRMA olarak da bilinir, bir maddenin kimyasal yapısını değiştirmek amacıyla, bu maddenin içinden elektrik akımı geçirmeye dayanan kimyasal işlem. Bu değişiklik, maddenin bir elektron vermesinden (yükseltgenme) ya da almasından (indirgenme) kaynaklanır. Elektroliz işlemi, elektroliz kabı ya da tankı da denen bir aygıt içinde uygulanır. Bu aygıt, çözünerek ya da eriyerek artı ve eksi yüklü iyonlara ayrılmış bir bileşiğin (elektrolit) içine birbirine değmeyecek biçimde daldırılmış iki elektrottan oluşur. Elektrikle ayrıştırılacak madde ya kabın içindeki elektrolittir, ya bu çözeltide çözünmüş bir maddedir ya da çözeltiye daldırılan elektrotlardan biridir. Bir metal ya da metalik bir iletken olan bu elektrotlara doğru akım verildiğinde, biri artı, öbürü eksi elektrik yüklenir. Sonuçta, elektrolitteki artı yüklü iyonlor (katyon) eksi yüklü elektrota (katot) yönelir ve bu metalden kopan elektronları alarak yüksüz ya da daha düşük yüklü iyon ya da moleküllere dönüşür.
Sponsorlu Bağlantılar
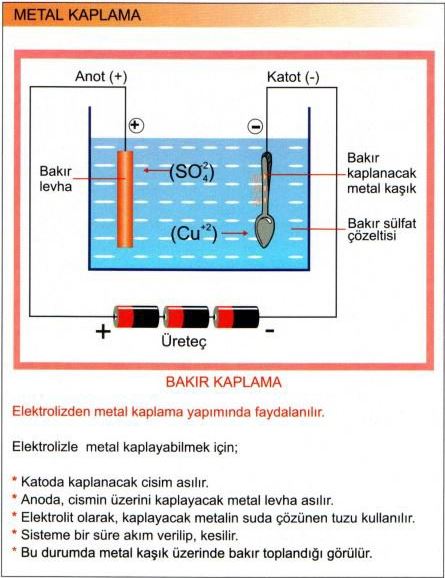
Aynı anda, çözeltinin eksi yüklü iyonları da (anyon) artı yüklü elektrota (anot) doğru yönelir ve elektronlarının bir bölümünü bu metale vererek yüksüz iyonlara ya da moleküllere dönüşür. Her iki süreç de, eksi yüklü iyonlardan artı yüklü iyonlara elektron aktarımıyla gerçekleşen bir yükseltgenme-indirgenme tepkimesidir. Elektroliz işlemi, cevherlerden ya da bileşiklerden metallerin özütlenmesi ya da arıtılması, bir çözeltideki metallerin çökeltilmesi (elektrikli kaplama) gibi metalürji işlemlerinde yaygın olarak kullanılır. Metal halindeki sodyum ile klor gazı, erimiş sodyum klorürden (sofra tuzu) elektroliz yoluyla üretilir. Sodyum klorürün sulu çözeltisinin elektrolizi ise sodyum hidroksit ve klor gazı verir. Hidrojen ve oksijen de suyun elektroliziyle elde edilir.
Tepkimeye girdiklerinde enerji tüketmek yerine kimyasal enerji üreten bazı maddelerin tepkimesinde, indirgenme ve yükseltgenme tepkimelerinin iki ayrı elektrot üzerinde ayrı ayrı gerçekleşmesi sağlanabilirse, üretilen bu enerjinin tümü ya da bir bölümü elektrik enerjisine dönüştürülebilir. Örneğin kurşunlu akümülatörlerde, kurşun dioksit, element halindeki kurşun ve sülfürik asidin tepkimesinden kurşun sülfat ve su oluşur. Bu tepkimedeki süreçlerden biri, elektrotlardan birine yönelen kurşunun kurşun sülfata yükseltgenmesi, öbürü de ikinci elektrotta kurşun dioksitin kurşun sülfata indirgenmesidir; bu tepkime sırasında elektrik yüklerinin hareketini sağlayan, hidrojen iyonlarının elektrolit içindeki yer değiştirmesidir. Bu süreçler, elektrotları birbirine bağlayan dış devre üzerinde elektrik akımı doğuran itici bir güç (gerilim) yaratır.
kaynak: Ana Britannica
Son düzenleyen Safi; 13 Şubat 2018 01:59
Şeytan Yaşamak İçin Her Şeyi Yapar....

 Elektroliz Nedir?
Elektroliz Nedir?