Proteinler
C : %50,
O : %23,
N : %16
H : %7
S %0-3,
P %0-3, iz miktarlarda Fe, Zn ve Cu içerirler. Proteinlerin genel kimyasal formülü

Proteinler hayvanlarda canlı maddeye miktar olarak en çok katılan yapı taşıdır.
Karaciğer, kas ve böbrek %78-80
Taze kas % 18-20,
kan plazması % 6.5-7.5
beyin % 8,
yumurta sarısı % 15,
yumurta akı % 12,
inek sütü % 3.3
çeşitli peynir türleri % 14-49 protein içerir.
Protein kuruluşu
- marul %1.2,
- lahana ve pancar %1.6,
- patates %2 protein içerirken
- kuru fasulye %18-22, badem %21, yer fıstığı %26,
- soya fasülyesi %37 protein içerir
- Elma, çilek, şeftali, armut, erik ve turunçgillerde protein oranı çok düşüktür (%0,4-1,5).
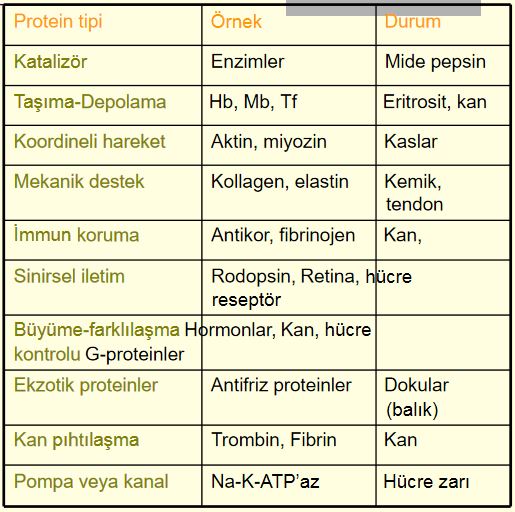
Protein Fonksiyonu
- Proteinler çeşitli biyolojik görevlere sahip çok kompleks moleküllerdir
- Farklı proteinler amino asitlerin farklı dizilişiyle mümkündür (EVCİL ve CİLVE gibi)
- Sindirim enzimleri, biyolojik deterjan, pupa, yün, tırnak, boynuz, et, yumurta akı, dokuma kumaşlar (bitkisel protein) örnek oluşturur.
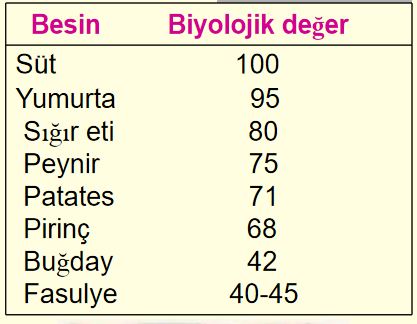
Besinsel proteinlerin biyolojik değeri
Bir proteinde biyolojik değeri belirlemede iki faktör dikkate alınır:
- Kolay sindirilebilirlik
- İçerdiği zorunlu amino asit miktarı ve çeşitliliği
- Bu açıdan hayvansal proteinler bitkisel proteinlere nazaran daha değerli olduğu söylenebilir
Proteinlerin Genel Özellikleri
Yapı: 20 aa repertuvarından oluşan dallanmamış polimerler Boyut: Bir polipeptidde aa sayısı 50-38000 arasında değişir Bu moleküllerin kütleleri 6-4200 kDa arasındadır
Organizasyon: Kompleks proteinler çok sayıda benzer polipeptidden yada birkaç farklı polipeptidin karışımından oluşur
20 Amino asit farklı yapı ve boyutta yaklaşık 100,000 farklı protein oluştururlar
- Yirmi çeşit yan zincir amino asitlerde boy, yapı, yük, hidrojen bağı oluşturma kapasitesi ve kimyasal reaktiviteyi değiştirerek proteinleri kurarlar.
- Gerçekten, bakteriden insana kadar tüm türlerde bütün proteinler 20 amino asitten kurulur.
- Proteinlerin bu temel alfabesi yaklaşık iki milyar yaşındadır.
- Proteinlerin dikkat çekici fonksiyonları 20 amino asidin çeşitli bloklar inşa etmeleri sonucudur. İşte bu bloklar amino asitlerin repertuvarıdır.
Proteinlerde Fiziksel ve Kimyasal Özellikler
- Proteinler özellikleri bakımından oldukça değişik olabilirler.
- Örneğin yumurta akı proteini ısıtmakla denatüre olur, suda az erir ve kolaylıkla reaksiyon gösterir.
- Buna karşın tırnakta bulunan keratin erimez, kimyasal olarak nisbeten reaksiyon yeteneği olmayan dayanıklı bir proteindir. Protein molekülleri çok büyüktür, nişasta ve glikojen gibi kolloiddir.
- Proteinler saf halde, ısıtılınca erimezler, ayrışırlar ve karakteristik kokulu gazlar çıkararak yanarlar (tüy yanması).
- Çeşitli proteinler değişik eritkenlerde (su, sulandırılmış nötral tuz çözeltileri, sulandırılmış asitler veya bazlar, %70-80 alkol, salisilat, yoğun üre çözeltisi ve gliserin vb) erirler.
- Protein çözeltileri kolloidal ve opal görünüştedir
- Bir çok protein çözeltisi ısıtıldığında protein molekülleri erimez hale geçip pıhtılaşır (koagülasyon).
Fiziksel Özellikler
Tad: Saf proteinler tatlıdır.
Koku: Saf proteinler kokusuzdur
Eriyebilirlik ya da Çözünürlük: Her protein belirli bir çözücüde karakteristik bir erime özelliğine sahiptir. Bir kısmı suda ve tuz çözeltilerinde erimezken (skleroprotein), bazıları suda ve tuz Çözeltilerinde kolay erir (albumin), diğer bazıları ise suda az, tuz Çözeltisinde çok erirler (globulin).
Tuzlar bir proteinin eriyebilirliğini azaltabilir veya artırabilir. Protein eriyebilirliğinin artışında tuzların etkisi Salting-inn etki
Nötral tuzların yüksek konsantrasyonlarıyla sulu çözeltilerinde çökeltilirler. Bu da Salting-out etki olarak bilinir.
Çözünme hidrofilik iyonik grupların etrafında su moleküllerinin toplanması ile ilgilidir,İyonlar üzerinden su moleküllerinin çekilmesi protein eriyebilirliğini düşürür. Bazı yapısal proteinler çözünmez özelliktedir. Proteinler pI da en az çözünebilir özelliktedirler.
Ozmotik Basınç: Molekül büyüklüğü nedeniyle proteinler yarı geçirgen zarlardan geçemezler. Bu nedenle; zarlar üzerine diğer elektrolitler gibi ozmotik basınç uygularlar. Kolloid olmalarından dolayı da kolloid ozmotik basınç (onkotik basınç) oluştururlar.
Molekül ağırlığı : Proteinlerin molekül ağırlıkları birkaç binden- birkaç milyona kadar değişebilir. Proteinlerde molekül ağırlığı Dalton (Da) yada kilodalton (kDa) ile ifade edilir. Albumin 68 000 Da (68 kDa)
Amfoter özellik: Proteinler yüzeylerinde pozitif ve negatif elektrik yük taşıyan polielektrolittir: plda pozitif ve negatif yük sayıları eşittir. Proteinler amfolittirler ve hem asitlerle hem de bazlarla birleşerek tuz oluşturabilirler. Bu özellikleri nedeniyle de biyolojik tampon olarak asit-baz dengesinde görev alırlar.
İyonizasyon ve elektroforez: Protein çok sayıda iyonlaşabilir gruplar içerir. Bu grupların yükleri iyonlaşma katsayısı (pK) ve çözeltinin pHsı ile ilişkilidir. Düşük pHda negatif yüklerden daha çok pozitif yük kazanır ve protein katyon olup bir elektrik alanda katoda göçer (elektroforez). Yüksek pHda ise protein daha fazla negatif yükle yüklenir ve anyon olarak anota göçer. Elektrik yüklerinin nötr olduğu pHda (pI) ise protein yüksüz
olduğu için göçmez, hareketsizdir.
UV ışık absorbsiyonu: Proteinlerde mevcut F, Y ve W aa varlığı ile ilgilidir. Bu amino asitler sahip oldukları konjuge çift bağlar nedeni ile 260-280 nm dalga boyundaki UV-ışınları absorbe ederek onlara özgü pik verirler.
Işık difüzyonu (Tyndall olayı): Proteinler kolloid olmaları nedeniyle çözeltilerinde üzerlerine dik gelen UV ışığı önce absorblayıp sonra yayarak çözeltinin sigara dumanı görünümü almasına neden olurlar.
Proteinlerde optik rotasyon: Proteinler polarize ışığı saptırırlar(-30o)-(-60o) Denatürasyonda spesifik rotasyonlar daha negatiftir. Böylece optik rotasyondaki değişiklik genellikle konformasyondaki değişikliği yansıtır.
NMR: Proteinlerdeki konformasyonal değişimi esas alan bir inceleme yöntemidir
Kimyasal Özellikler
1. Proteinlerin kimyasal yapısı: Proteinler yakalaşık olarak %50 C, %23 O, %7 H, %16 N ve çok iz miktarlarda olmak üzere de S, Cu, Fe, Zn, Mn gibi elementlerden kurulmuşlardır.
Proteinlerin %16 oranında N içermesinden yararlanılarak toplam N miktarı ölçülen herhangi bir biyolojik sıvının toplam protein miktarı da hesaplanabilir: P=Nx100/16 ya da P=Nx6,25
2. Proteinlerin hidrolizi: Proteinler asitlerle, alkalilerle ve enzimlerle muamelede su alarak kendilerini kuran alt birimlere (monomerlerine veya peptid ya da amino asitlerine) ayrılabilirler bu olaya hidroliz denir.
Sindirim enzimleri besinlerle alınan proteinleri hidroliz ile amino asitlerine ve peptidlere parçalarlar.
3. Protein molekülünde bazı amino asitlerin varlığına ilişkin tepkimeler: Amino gruplarına ait tepkimeler - metilasyon, dinitrofenilasyon, deaminasyon.
Hidroksil veya fenol gruplarına ait tepkimeler - esterleşme, fosforilasyon
Sülfidril gruplarına ait tepkimeler - asetilasyon, trifluoroasetilasyon
İmidazol veya fenol grubuna ait H in iyot ile substitüsyonu 4. Proteinlerin renk tepkimeleri: Proteinler, bazı renk tepkimeleri verirler. Bunlar proteinlerin kalitatif/kantitatif tayinine hizmet eder.
5. Çöktürme tepkimeleri: Proteinler liyofilik kısmen hidrofilik kolloidlerdir. Sisteme dayanıklılığı veren hem elektrik yük hem de protein ile eritken arasındaki karşılıklı etkidir. Bu etkenlerden birisi etkisiz kılınırsa protein bazan çöker, her ikisi de etkisiz kılınırsa protein daima çöker. Çökme izoelektrik noktada daha kolaydır.
Nötr tuzlar, etanol vb çok hidrofil maddeler suyu çekerler ve proteini çöktürürler.
Proteinlerde denatürasyon: Peptid bağında kopma olmaksızın molekül içinde üç boyutlu organizasyonun herhangi bir kuvvet tarafından değiştirilmesidir. Denatürasyon sonrası protein artık fizyolojik aktiviteye sahip değildir (denatüre protein)
Denatürasyon etkenleri : Proteinler ısı, asitler ve bazlar, organik çözücüler, metal iyonları, üre ve guanidin, iyonik deterjanlar ve redükleyici etkenler proteinleri denatüre ederler.