Maddenin Halleri Arasındaki Dönüşüm
Maddenin katı, sıvı ve gaz olmak üzere üç hâli vardır. Genel olarak madde ya katı ya sıvı ya da gaz hâlinde bulunur. İstenildiğinde ortam şartları elverişli hâle getirilerek bir hâlden diğerine dönüştürülebilir.
Maddenin katı hâli, belirli bir şekle ve hacme sahiptir. Katı maddeyi oluşturan atom ve moleküller birbirine çok yakındır. Aralarındaki boşluklar çok azdır. Atom ve moleküller arasında bir düzenlilik vardır.
Maddenin sıvı hâli,belirli bir şekle sahip değildir. Sıvılar akışkan olduklarından bulundukları kabın şeklini alır. Sıvı hâlde atom veya moleküller katılardan daha düzensiz olup tanecikler arası boşluklar katılardan daha fazladır.
Maddenin gaz hâli, atom veya molekülleri arasında boşlukların çok olduğu durumdur. Gaz tanecikleri düzensiz olarak hareket ederler. Bu hareketleri sırasında gaz molekülleri birbiri ile homojen olarak karışabilirler. Bunların yayılmaları hissedilebilir veya gözle takip edilebilir. Bir odaya damlatılan bir kolonyanın kokusu kısa sürede hissedilirken, bir sigara dumanının yayılması da gözle takip edilebilir. Gazların belirli bir şekil ve hacimleri yoktur. Konuldukları kabı dolduracak şekilde genleşerek kabın şeklini ve hacmini alırlar.
Bir madde farklı sıcaklık ve basınç şartlarında üç hâlde de bulunabilir. Örneğin, saf su, H2O ile formüle edilir. Katı hâlde buz, sıvı hâlde su ve gaz hâlinde su buharı şeklinde bulunur.
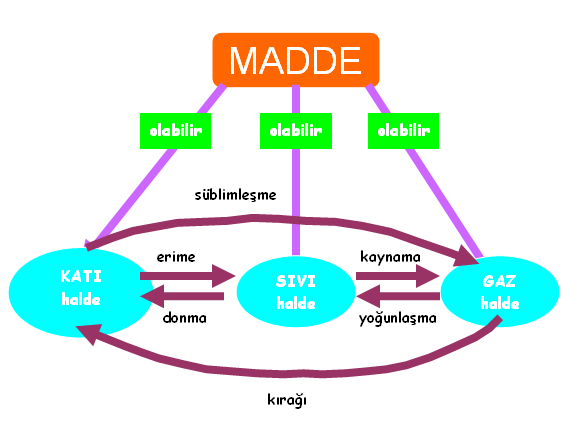
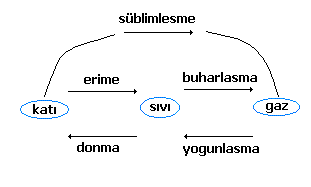
Maddeler üç fiziksel halde bulunabilir. Katı , sıvı ve gaz haller. Madde bu üç hal arasında geçişler yapabilir. Örneğin katıdan sıvıya, sıvıdan gaza, katıdan gaza geçer veya bunların tersini yapabilir. Maddenin katıdan sıvıya geçmesi olayı erime, sıvıdan gaza geçmesi olayı buharlaşma (veya kaynama), bu olayların tersi, yani, sıvıdan katıya geçme donma, gazdan sıvıya geçme yoğunlaşmadır.
Katı ------->-------erime------->--------> Sıvı ------->--------buharlaşma-------->--------> Gaz Katı -------<-------donma-------<--------< Sıvı -------<--------yoğunlaşma--------<--------< Gaz Katı ------->-------------->--------> süblimleşme------->---------------->---------> Gaz Katı -------<--------------<--------< depozisyon-------<----------------<---------< Gaz
Hal Değişimi
Bir maddenin katı, sıvı ve gaz halleri arasında geçişler yapmasına hal değiştirme denir.
- Erime: Bir maddenin katı halden sıvı hale geçmesine erime, erimenin meydana geldiği sıcaklığa erime sıcaklığı denir.
- Donma: Bir maddenin sıvı halden katı hale geçmesine donma, donmanın meydana geldiği sıcaklığa donma sıcaklığı denir.
- Kaynama: Bir maddenin sıvı halden gaz hale geçmesine kaynama, kaynamanın meydana geldiği sıcaklığa kaynama sıcaklığı denir. Kaynama ile buharlaşma aynı şey değildir.
- Buharlaşma her sıcaklıkta olurken kaynama belirli bir sıcaklıkta olur. Kaynama buharlaşmanın en yoğun olduğu andır.
- Yoğunlaşma: Bir maddenin gaz halden sıvı hale geçmesine yoğunlaşma, yoğunlaşmanın meydana geldiği sıcaklığa yoğunlaşma sıcaklığı denir.
- Süblimleşme: bir katının sıvı hale geçmeden gaz hale geçmesine süblimleşme denir. Naftalin ve tuvaletlerde kullanılan katı koku gidericiler buna örnektir.
- Kırağılaşma (Depozisyon): Kırağılaşma gazların katılara dönüşmesidir. Kırağılaşmanın tersine ise süblimleşme denir.
Hal değiştirme ısısı [L]: 1 gram maddeyi bir halden başka bir hale geçirmek için ona verilmesi veya ondan alınması gereken ısıdır. Eğer madde eriyorsa erime ısısı (Le), kaynıyorsa kaynama ısısı (Lk) adını alır.
Özısı (c): Bir maddenin 1gramının sıcaklığını 1°C değiştirmek için ona verilmesi veya ondan alınması gereken ısıdır. Hal değişimi sırasında erime ve kaynama noktalarında bir süre sıcaklık değişmez alınan ısı moleküllerin arasındaki bağları çözmek için harcanır. Bu noktalarda harcanan enerji aşağıdaki gibi hesaplanır.
Q= m.L
- Q= Isı
- m= Kütle
- L= Bu harlaşma yada erime erime ısısı
Hal değişiminde yukarıda anlatılan süre dışında harcanan ısı enerjisi miktarı aşağıdaki formül ile hesaplanır.
Q=m.c.DELTAt
- Q = ısı
- m = kütle
- c = öz ısı
- DELTAt= sıcaklık değişimi
Hal Değiştirme ile İlgili Özellikler
- Hal değiştirme süresince sıcaklık sabit kalır.
- Bir madde için;
- erime sıcaklığı=donma sıcaklığı
- kaynama sıcaklığı=yoğunlaşma sıcaklığı
- erime ısısı=donma ısısı
- kaynama ısısı=yoğunlaşma ısısı
- Her maddenin belirli bir basınç altında belirli bir erime noktası vardır. Erime sırasında hacmi artan maddeler de donma noktası basıncın artmasıyla artar. Erime sırasında hacmi azalan maddelerin donma noktası basıncın artmasıyla azalır, yani daha düşük sıcaklıklarda donar. Buzun üzerine basıldığında 0°C den daha düşük sıcaklıklarda da erimesi buna örnektir.
- Her sıvının belirli bir basınç altında belirli bir kaynama noktası vardır. Basınç azaldıkça kaynama noktası düşer. Çünkü kaynama buhar basıncı ile dış ortam basıncın eşitlendiği anda başlar. Yükseklere çıkıldıkça atmosfer basıncı azaldığından kaynama noktası düşer.
- Isı çoğaldıkça buharlaşma kolaylaşır.
- Hava akımı buharlaşmayı kolaylaştırır.
- Sıvı yüzeyi genişledikçe buharlaşma kolaylaşır.
- Basınç azaldıkça buharlaşma kolaylaşır.
- Erime, donma, kaynama, yoğunlaşma sıcaklıkları, özısı, hal değiştirme ısıları maddenin ayırt edici özelliklerindendir.
ISI: Bir maddenin bütün moleküllerinin sahip olduğu çekim potansiyel enerjileri ile kinetik enerjilerinin toplamına ısı denir. Isı bir enerji türüdür, diğer enerjilere dönüşebilir.
SICAKLIK: Bir maddenin moleküllerinin ortalama kinetik enerjilerinin bir ölçüsüdür. Enerji değildir.
Isı ile sıcaklık arasındaki ilişki, potansiyel enerji ile yükseklik arasındaki ilişkiye benzetilebilir. Nasıl ki EP=mgh bağıntısındaki h enerji değilse; Q=mcDt bağıntısındaki sıcaklığı ifade eden Dt de enerji değildir. Isı kalorimetre kabı, sıcaklık termometre ile ölçülür. Sıcaklık birimi günülük hayatta °C, teknikte °K'dir.
Kaynama dış basınca bağlı olup, basınç arttıkca kaynama noktası yükselir. Açık bir kapta su 100°C de kaynar. Kapalı kapta buhar basıncı artacağından kaynama noktası yükselir. Düdüklü tencerelerde sıcaklık 100°C üzerine çıkacağı için yemekler daha kısa sürede pişer.
Örnek
Süs balıklarına meraklı bir öğrenci bir Japon balığı alıyor. Balığı evde kaynatılıp soğutulmuş suya koyuyor. Kısa bir süre sonra balığın can çekişmekte olduğunu görüyor. Size göre balığa ne olmuştur? Balığı kurtarmak için ne yapmalısınız?
Süs balığı su içerisindeki yetersiz oksijenden dolayı can çekişmektedir. Çünkü evde suyu kaynatarak içerisinde bulunan minerallerle beraber oksijen miktarını da azaltmış olduk. Süs balığı bu su içerisin de gereksinimi olan oksijeni alamadığından dolayı can çekişmeye başladı. Balığı kurtarmak için hemen musluk suyu ile doldurulmuş başka bir kaba koymalıyız. Birazda içerisine tuz atmalıyız.
Son düzenleyen perlina; 14 Aralık 2016 17:55
Tanrı varsa eğer, ruhumu kutsasın... Ruhum varsa eğer!