REDOKS REAKSİYONLARI
Elektrokimyasal prosesler, kendiliğinden meydana gelen ve elektrik üreten kimyasal reaksiyonların veya bir elektrik akımının kimyasal bir reaksiyona yol açtığı proseslerdir. Bir redoks reaksiyonunda, bir atom veya iyonunoksidasyon derecesi (kısaca elektrik yükü) elektron transferi sonucu değişir.
Oksidasyon ve Redüksiyon Bir elektrokimyasal reaksiyonda yer alan elementler, sahip oldukları elektron sayısı ile karakterize edilirler. Bir iyonun oksidasyon seviyesi, nötr haline oranla aldığı veya verdiği elektron sayısıdır. Eğer bir atom veya iyon, bir reaksiyonda bir elektron verirse oksidasyon seviyesi yükselir, ya da tam tersine, eğer elektron alırsa oksidasyon seviyesi düşer. Örneğin, sodyum, klor ile reaksiyona girdiğinde bir elektron verir ve 1+ oksidasyon seviyesi kazanır. Klor da böylece bir elektron alarak 1- oksidasyon seviyesi kazanır. Oksidasyon seviyesinin işareti (+ veya - oluşu) her bir iyonun elektronik yüküne karşı gelir. Zıt elektrik yüklü sodyum ve klor iyonlarının birbirini çekmesi, iyonik bağ oluşturmalarının nedenidir. Bir maddennin elektron vermesi oksidasyon, elektron kazanması ise redüksiyondur. Elektron veren bir madde redükleyici, elektron alan madde ise oksitleyici olarak bilinir. Oksitleyici madde reaksiyonda redüklenir, redükleyici madde ise oksitlenir. Oksidasyon ve redüksiyonun aynı anda meydana geldiği reaksiyonlar redoks reaksiyonları olarak bilinir. Bu tür reaksiyonlarda maddelerden birisi elektron alırken diğeri elektron verir. Oksidasyonda bir oksitleyiciye gereksinim vardır. Oksijen bir oksitleyicidir ama tek oksitleyici değildir. Adına rağmen, oksidasyon reaksiyonunda oksijenin bulunmasına gerek yoktur. Nitekim, bir ateş, oksijenden başka bir oksitleyici ile beslenebilir; örneğin flor yangınları genellikle kolay kolay söndürülemez, zira flor, oksijenden daha kuvvetli bir oksitleyicidir (elektronegatifliği oksijenden daha yüksektir). Redoks Reaksiyonlarının Dengelenmesi Sulu çözeltilerdeki elektrokimyasal reaksiyonlar, redoks reaksiyonlarının iyon-elektron metodu kullanılarak dengelenmesiyle daha iyi anlaşılabilir. Bu metotta, H+ , OH- iyonları, H2O ve elektronlar (oksidasyon değişikliklerini kompanse etmek için) hücrenin yarı-reaksiyonlarına ilave edilirler. Asidik Ortam Asidik ortamda, genel reaksiyonu dengelemek için yarı-reaksiyonlara H+ iyonları ve su ilave edilir. Örneğin, manganez sodyum bizmutat ile reaksiyona girdiğinde;
Dengelenmemiş reaksiyon:  Oksidasyon:
Oksidasyon: 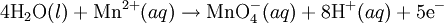 Redüksiyon:
Redüksiyon: 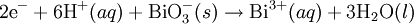 Nihayet reaksiyon, redüksiyon yarı-reaksiyonundaki elektron sayısı ile oksidasyon yarı-reaksiyonunu, ve oksidasyon yarı-reaksiyonundaki elektron sayısı ile redüksiyon yarı-reaksiyonunu çarparak dengelenir.
Nihayet reaksiyon, redüksiyon yarı-reaksiyonundaki elektron sayısı ile oksidasyon yarı-reaksiyonunu, ve oksidasyon yarı-reaksiyonundaki elektron sayısı ile redüksiyon yarı-reaksiyonunu çarparak dengelenir. 
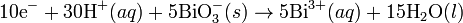 Dengelenmiş Reaksiyon:
Dengelenmiş Reaksiyon: Alkali Ortam Alkali ortamda, genel reaksiyonu dengelemek için, yarı reaksiyonlara OH– iyonları ve su ilave edilir. Örneğin, potasyum permanganat ile sodyum sülfit arasındaki reaksiyonda: Dengelenmemiş reaksiyon:
Alkali Ortam Alkali ortamda, genel reaksiyonu dengelemek için, yarı reaksiyonlara OH– iyonları ve su ilave edilir. Örneğin, potasyum permanganat ile sodyum sülfit arasındaki reaksiyonda: Dengelenmemiş reaksiyon:  Redüksiyon:
Redüksiyon:  Oksidasyon:
Oksidasyon:  Asidik ortamdakine benzer şekilde, zıt yarı reaksiyonların elektron sayıları ile çarpılarak genel reaksiyon dengelenir.
Asidik ortamdakine benzer şekilde, zıt yarı reaksiyonların elektron sayıları ile çarpılarak genel reaksiyon dengelenir. 
 Dengelenmiş Denklem:
Dengelenmiş Denklem:  Nötr Ortam Asidik ortamda kullanılan metot izlenir. Örneğin, propan gazının tam yanma reaksiyonunun, elektron iyon metodu kullanılarak dengelenmesi gibi: Dengelenmemiş reaksiyon:
Nötr Ortam Asidik ortamda kullanılan metot izlenir. Örneğin, propan gazının tam yanma reaksiyonunun, elektron iyon metodu kullanılarak dengelenmesi gibi: Dengelenmemiş reaksiyon:  Redüksiyon:
Redüksiyon: 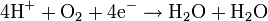 Oksidasyon:
Oksidasyon:  Asidik ve bazik ortamlardakine benzer şekilde, zıt yarı reaksiyonların elektron sayıları ile çarpılarak genel reaksiyon dengelenir.
Asidik ve bazik ortamlardakine benzer şekilde, zıt yarı reaksiyonların elektron sayıları ile çarpılarak genel reaksiyon dengelenir. 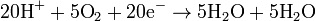 Dengelenmiş Denklem:
Dengelenmiş Denklem: