Pil
El fenerinin ışık vermesi, kapı zilinin ya da el radyosunun çalması için gerekli elektrik enerjisini sağlayan piller, daha büyük boyutlu işler, örneğin bir telefon santralına gerekli enerjinin sağlanması için de kullanılabilir. Birbirine bağlı birden çok pilden oluşan elektrik enerjisi kaynaklarına da batarya elenir. Geçici enerji kaynaklarıdır ve bulundukları konumlara geçicici enerji sağlarlar. Elektrik devresinin asıl güç kaynağıdır. Voltlarına göre güç durumları da artar/azalır.
1794'te İtalyan fizikçi Alessandro Volta, bir tuz çözeltisine, daldırılmış iki farklı metal parçasını bir telle birbirine bağladığında telden elekttık akımı geçtiğini keşfetti. Volta daha sonra tuz çözeltisine, bu iki metalden oluşan birçok başka metal çifti daldırdı ve onları birbirinden ayırmak için aralarına karton levhalar yerleştirdi. Volta, pila adını verdiği bu düzeneğin iki ucundaki metallere dokunduğunda küçük bir elektrik şoku hissetti. Bu basit elektrik düzeneğine sonradan Volta pili adı verildi.
Bu ilk pildi. Daha sonra pil yapımında birçok gelişme oldu; ama bütün piller, içlerinde gerçekleşen kimyasal değişim sonucu elektrik akımı veren aygıtlardır.
Başlıca iki pil türü vardır. Kısaca pil denen birincil piller, içerdiği kimyasal maddeler tükenene kadar elektrik akımı üretir; sonra yeniden kullanılamaz. Akürnülatör denen ikincil pilici ise kullanılıp bittikten sonra elektrikle yüklenerek yeniden kullanılabilir. Motorlu taşıtlarda kullanılan akümülatörleı ya da kısaca aküler bu türe örnektir.
Piller kuru, yaş ve katı elektrolitli olarak üç türe ayrılır. En çok kullanılan birincil pil olan Leclanche pilini ilk kez 1868'de Fransız mühendis Georges Leclanche' kullanmıştır. Leclanche pilinin bir canı kavanoz içinde yapılan yaş türü ve metal bir kap içinde yapılan kuru türü vardır. Genellikle kısaca kuru pil denen kuru Leclanche pilleri kapı zili, el feneri ve el radyosu gibi az. elektrik akımı gerektiren aygıtlarda kullanılır. Daha büyük miktarlarda elektrik akımı sağlamak için ikincil pillerden yararlanılır. Bunlar genellikle kurşunlu akü-mülatörlerdir.
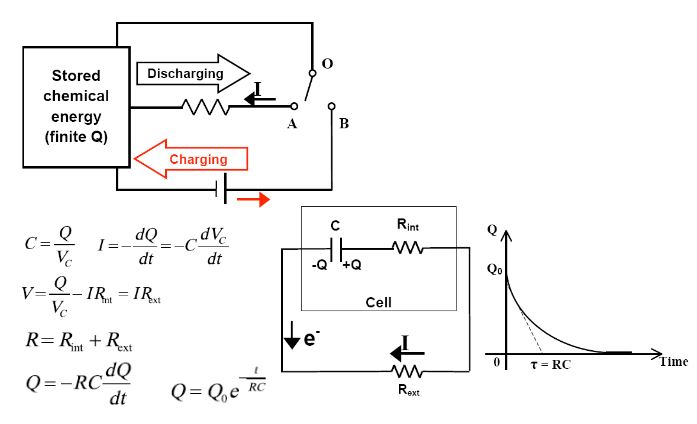
Piller Çalışma Prensibi:
Piller elektrik enerjisini biriktirir ve gerektiğinde kullanır. Elektrokimyasal olarak bir
metal kendi iyonları içeren bir sıvıya daldırılırsa potansiyel farkı meydana gelir.
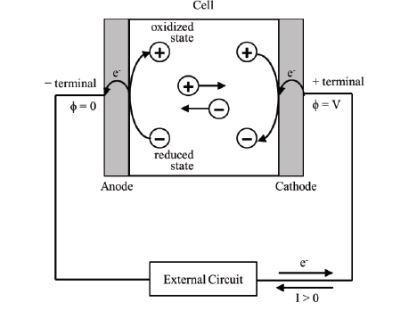
M → M+ + e Yükseltgenme
M+ + e → M İndirgenme
Yükseltgenmenin olduğu elektrot anot, indirgemenin olduğu elektrotta katotdur.
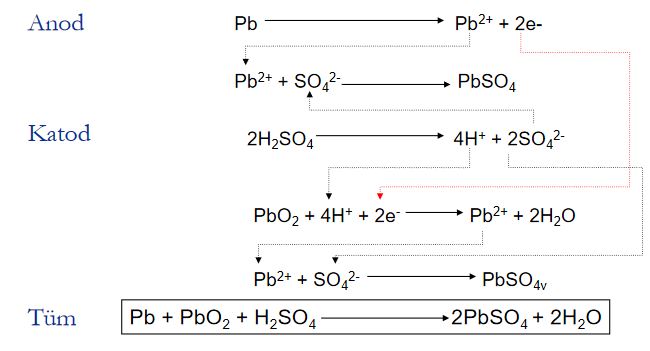
Pillerde Kimyasal Reaksiyon:
Örnek: Kurşun asid pilin deşarjı
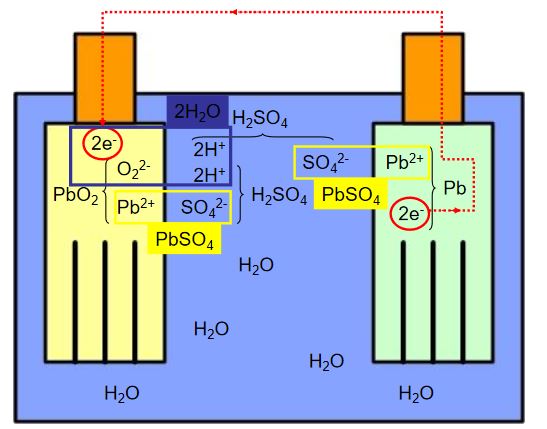
Pilin Deşarj durumunda teorik elektriksel modeli:
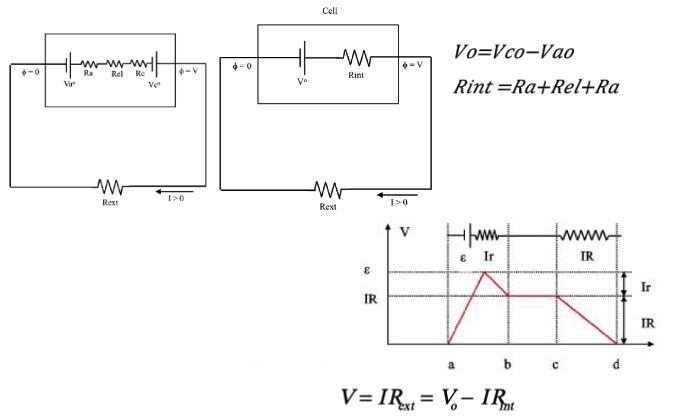
Pillerin Şarj Durumunda teorik elektriksel modeli:
Pillerin Bağlanması
Taşınabilir cihazlar bazen birden fazla pile ihtiyaç duyabilirler. Bu cihazın işletim gerilimine ve işletim akım değerine bağlıdır. Örneğin çinko-karbon pilleriyle 3 adet pilin artı ve eksi uçları birbirine bağlanarak (seri bağlama) 4,5 voltluk (1,5 x 3) gerilime sahip bir batarya elde edilebilir. Aynı şekilde, bir saatte 1000 miliamper akım üretebilen 1,5 voltluk 3 adet benzer pilin artı uçları birbirlerine ve eksi uçları da yine birbirlerine bağlanılarak (paralel bağlama) 3000 milamperlik akım üretebilen 1,5 volt gerilim değerine sahip bir batarya meydana getirebilir.
Seri veya paralel bağlanacak pil sayısı dış etkenlere, özellikle sıcaklığa bağlı olarak sınırlıdır. Ayrıca sekonder pillerin sistemin dengesini bozacağı nedeniyle paralel bağlanmaları tavsiye edilmez.
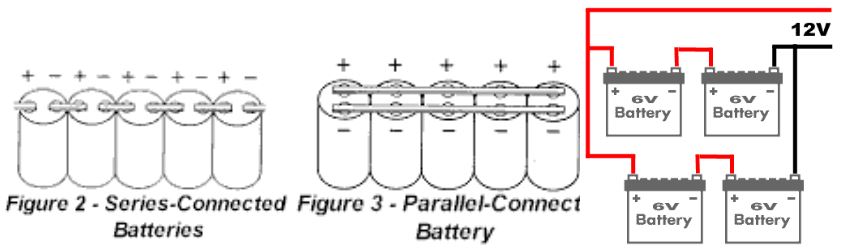
Bir pilin bir elektrik devresinden elektrik yükü akıtabilme kuvvetine elektromotor kuvvet (EMK) denir. Voltla ölçülen elektromotor kuvvet, pilin yapımında kullanılmış olan metallerin ve çözeltinin türüne gene değişir. Leclanche pilinin elektromotor kuvveti 1,5 volttur.
Volta'nın yaptığı gibi çok sayıda pili birbirine bağlayarak daha büyük bir elektromotor kuvvet elde edilebilir. Örneğin, elektromotor kuvveti 1,5 volt olan 10 pili birinin artı ucu öbürünün eksi ucuna bağlanacak biçimde, bir araya getirirsek, bu bataryanın elektromotor kuvveti 10x1,5=15 volt olur. Pillerin bu biçimde birbirine bağlanmasına seri bağlama denir. Eğer bu pillerin artı uçlarını birbirine eksi uçlarını da birbirine bağlayarak bir batarya yaparsak, bu bataryanın elektromotor kuvveti bir pilin elektromotor kuvveti olan 1,5 volttur; ama bu kez bataryanın kullanım süresi artar. Büyük kapasiteli uzun ömürlü bir batarya yapmak için pillerin bu biçimde birbirine bağlanmasına paralel bağlama denir.
İngiliz bilim adamı Francis Thomas Bacon' ın 1959'da bulduğu yakıt pili, hidrojen ve oksijenin birleşip su oluşturmasıyla çalışır. Elektrolizin tam tersi olan bu süreçte çok miktarda elektrik enerjisi açığa çıkar. Uzay araçlarında elektrik enerjisi üretmek için kullanılmakta olan yakıt pillerinin elektrikli otomobillerde kullanılması için de denemeler yapılmaktadır. Yüksek verimli olduğu ve yakıtı ucuz olduğu için yakıt pilleri çok iyi bir elektrik enerjisi kaynağıdır.
Pil, bilim ve teknolojide kimyasal enerjinin depolanabilmesi ve elektriksel bir forma dönüştürülebilmesi için kullanılan bir aygıttır. Piller, bir veya daha fazla elektrokimyasal hücre, yakıt hücreleri veya akış hücreleri gibi, elektrokimyasal aygıtlardan oluşur.
Bilinen en eski insan yapısı piller, Bağdat Pilleridir. M.Ö. 250 ve M.S. 640 yılları arasında yapıldığı tahmin edilmektedir. Pillerin gelişimi, 1800 yılında İtalyan fizikçi Alessandro Volta tarafından geliştirilen Voltaik (Voltaic) pil ile başlamıştır. Dünya çapında pil endüstrisi (2005 yılı yaklaşık değeri) 48 milyon A.B.D doları ciroya sahiptir.1
Pil kapasitesi
Eğer bir pilin voltajı genel olarak sabitse, bir pilin enerji depolama kapasitesi pilin içinden geçebilen enerji miktarına göre değişir. Bu amper-saat olarak tanımlanır ve A-h ile gösterilir. 1 A-h 3600 coulomba eşittir. Eğer bir pil 1 saat boyunca kesintisiz 1 A veya 1 coulomb/sn. enerji üretebiliyorsa bu pilin kapasitesi 1 A-hdir. Pilin içinde ne kadar elektrolit ve elektrot varsa pil kapasitesi o kadar fazla olur. Bu yüzden içinde aynı voltajı sağlayan kimyasal reaksiyonlar meydana gelse bile küçük pillerin kapasitesi büyük pillere göre daha azdır. Hücreler içindeki kimyasal reaksiyonlardan dolayı, pillerin bitme süreleri akımın büyüklüğü, akım süresi, sıcaklık ve diğer başka faktörler gibi çevresel etmenlere göre değişebilir.
Pil üreticileri pillerini derecelendirmek için standart bir yöntem kullanmaktadırlar. Pil sabit akım ve sabit zamanda (10 saat 20 saat gibi) her hücre için belirlenmiş voltaja düşürülür. Mesela 100 A-h lık bir pil, 5 A'lık bir akım ve oda sıcaklığında 20 saat dayanmaktadır. Bir pilin verimliliği farklı boşalma hızlarında farklıdır. Düşük hızda boşaltılırken pilin enerjisi yüksek hızdaki boşalmaya göre daha verimli dağıtılır. Buna "Peukert Yasası" denir.
Çeşitleri
Genel olarak piller, kullanıldıktan sonra atılan (Non-rechargeable) ve tekrar şarj edilebilen (Rechargeable) piller olarak ikiye ayrılır.
Kullanıldıktan sonra atılan (şarj edilmeyen) piller:
- Çinko-karbon pil - Düşük maliyetli - az enerji gerektiren uygulamalar için.
- Çinko-klorid Çinkokarbon pilden biraz daha uzun ömürlüdür.
- Alkalin pil - Alkaline/manganez "uzun ömürlü" pillerdir , daha fazla güç ihtiyacı gerekriren uygulamalarda da kullanılabilir.
- Gümüş-oksit pil Genelde işitme cihazlarında kullanılır.
- Lityum (Lithium) pil Genelde dijital kameralarda kullanılır. Saat ve bilgisayar saatlerinde de kullanıldığı görülür.Çok uzun ömürlüdür, fakat pahalıdır.
- Merküri (Mercury) pil Genelde dijital saatlerde kullanılır.
- Çinko-hava pil Genel olarak işitme cihazlarında kullanılır.
- Isıl (Termal) pil Yüksek sıcaklık depolar. Askeri uygulamalarda önem taşır.
Şarj edilebilen (tekrar kullanılabilen) piller:
- Kurşun-asit pil Araçlar, alarm sistemleri ve kesintisiz güç ihtiyacı olan yerlerde kullanılır.
- Lityum-iyon pil Oldukça yaygın olan türdür. Yüksek şarj yoğunluğu vardır. Dizüstü bilgisayar, cep telefonları, mp3 çalarlar ve daha birçok taşınabilir dijital cihazda kullanılır.
- Lityum-iyon polimer pil Lityum iyon pilin temel karakteristiklerini taşır, farkı daha az şarj yoğunluğu olmasıdır. Bu pilin kimyası üreticinin ihtiyacına göre kullanım yeri avantajı yaratabilmesidir. (Örneğin; ultra ince pil)
- Sodyum-sülfür (NaS) pil
- Nikel-demir pil
- Nikel metal hibrid (Ni-MH) pil
- Nikel-kadmiyum pil - Li-Ion ve Ni-MH pil tiplerinin tüm uygulamalarında kullanılabilir. Bu pil, uzun şarj adedine sahiptir (1500 defanın üzerinde). Fakat diğer tiplere göre daha az enerji yoğunluğuna sahiptir. Ni-Cd piller eski teknolojide kullanılmakta olup, hafıza sorunlarına yol açmalarından dolayı yerini modern pillere bırakmaktadır.
- Sodyum-metal klorid pil
- Nikelçinko pil
- Erimiş tuz pili
Çevreye Etkisi
250 yıllık gelişiminden beri piller en pahalı enerji kaynakları arasında yer almaktadır, ayrıca bünyesinde çok pahalı ürünler hatta bazen riskli kimyasallar bulundurmaktadır. Bu yüzden günümüzde artık çoğu bölgede kullanılmış pillerdeki pahalı ve toksik maddelerin geri kazanımı için geri dönüşüm merkezleri bulunmaktadır. Piller yutulduğunda tehlikeli ve ölümcül olabilir.
bakıız Şarj Edilebilir Piller