VAN DER WAALS (Johannes Dıderık).
hollandalı fizikçi
(Leiden 1837 - Amsterdam 1923).
1908'de Amsterdam Üniversitesi'nde fizik kürsüsünün başına getirildi. 1910 Nobel fizik ödülünü aldı. Akışkanlar için bulduğu bir hal denklemiyle tanındı, bu hallerin yasasını buldu. En önemli çalışması, sıvı ve gaz hallerin sürekliliğidir (1873). Elektrolitik ayrışma üstüne incelemeler yazdı ve kılcallıkla ilgili bir termodinamik kuramı verdi.
Van der Waals denklemi, moleküller arasındaki etkileşim kuvvetleri belirli bir ölçüde dikkate alınarak elde edilen, akışkanların hal denklemi. Bu hal denklemi, gerçek gaz ve sıvıların özelliklerini ideal gazlar denkleminden daha mükemmel şekilde göz önüne alan basit bir yaklaşıklıktır. Van der Waals denklemi N molekülden oluşmuş bir akışkanın p basıncını, T sıcaklığı ve V hacmini aşağıdaki bağlantıyla birbirlerine bağlar: burada R ideal gazlar değişmezi, a ve b göz önüne alınan akışkana bağlı iki değişmezdir.
Bitişik hacim adı verilen b değişmezi, bir molün kapladığı kabul edilen minimum hacmi gösterir: gerçekte, kısa mesafede, iki mol birbirini iter ve Pauli'nin dışlama ilkesinden kaynaklanan bu itme, gazın, belli bir sınırdan daha küçük bir hacimde sıkıştırılmasını olanaksız kılar, iç basınç denen terimi Van der Waals etkileşim kuvvetlerinden kaynaklanır. terimi çok büyük olduğunda (ya ni düşük basınçlarda) bitişik hacim ve iç basınç gözardı edilebilir ve yeniden ideal gazlar denklemi elde edilmiş olur.
Van der Waals eşsıcaklık eğrileri;
sıvılaşma eşiği. Değişmez sıcaklıkta hacime bağlı olarak basıncı veren eğrilerin (eşsı- caklık eğrileri) biçimi, şekil 1de gösterilmiştir. Yüksek sıcaklıklarda bunlar, akışkanların davranışını göz önüne alan tekdüze eğrilerdir. Kritik sıcaklık denen belirli bir Tc sıcaklığının altında (buna denk düşen kritik eşsıcaklık eğrisinin yatak bir büküm noktası vardır), bunlar sahramı deneysel olarak gözlemlenmeyen karmaşık eğrilerdir. Bununla birlikte, şekil 2'deki taralı alanlar eşit olacak şekilde bu eşsıcak- lık eğrileri üzerinde yatay bir eşik yerleştirilebilirse, deneysel olarak gözlemlenen olaylara ilişkin iyi bir betimleme elde edilir; bu eşik sıvı-gaz evresi geçişine denk düşer: basınç ve sıcaklık değişmez kalırken hacim, sistemde varolan sıvı ve gaz oranlarına göre değişir.
Eğrinin kesikli çizgiyle çizilmiş bölümleri yarıkararlı hallere (aşırısoğutulmuş sıvı, aşırıdoyum buhar) denk düşer. (faz GEÇİŞİ, hal değişimi GECİKMESİ.) Buna karşılık, madde hiçbir zaman eğrinin nokta nokta çizilmiş bölümü üzerinde bir noktayla gösterilen bir halde gözlenemez. Kritik sıcaklığın üzerinde, sıvı-gaz geçişi gözlenemez ve sıvı ile gaz ayırt edilemez.
Van der Waals formülü,
Termodin. ideal bir gaz olarak göz önüne alınamayan bir gazın p basıncı, V hacmi ve T sıcaklığı arasındaki ilişkiyi veren formül, (p V=RT) hal denklemi bu durumda uygulanamayacağından, feın der Waals, gazların kinetik kuramından esinlenerek, değerleri göz önüne alınan gaza bağlı olan a ve b (kovolüm olarak adlandırılır) sabit sayılarını kullanarak bu eşitliği düzeltmeyi önerdi:
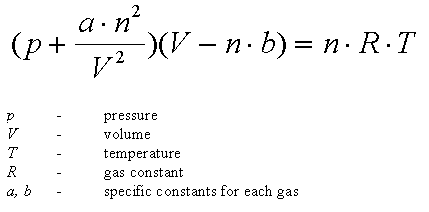
Bu formül birçok durumda iyi bir yaklaştıran sağlar.
Van der Waals kuvveti,
maddeyi oluşturan moleküller arasındaki elektrostatik kökenli çekim kuvveti. Çekirdeğin pozitif yükü, çekirdek çevresinde bir bulut oluşturan elektronların negatif yükleriyle denkleştiğinden, atomlar ve moleküller elektriksel olarak yansızdır. Pozitif ve negatif yükler aynı yerde olmadığından moleküller bir elektrik dipolü oluşturabilir. Su molekülü gibi kimi bakışımsız moleküllerde, negatif yüklerin ağırlık merkezi ortalama olarak pozitif yüklerin ağırlık merkeziyle çakışır ve kalıcı dipol yoktur. Bununla birlikte, belli bir anda, elektronların konumdaki dalgalanmalar nedeniyle yüklerin ağırlık merkezleri tam olarak çakışmaz ve molekül, çevresindeki uzayda bir elektrik alanı yaratan bir dipola sahip olur. İki elektrik dipolü birbirlerine birtakım kuvvetler uygularlar (dipol-dipol etkileşimi) ve kalıcı dipolleri olmayan iki atom ya da molekül arasındaki dipol etkileşim kuvvetinin, zaman içindeki ortalama değerine Van der Waals kuvveti adı verilir. Van der Waals kuvvetleri çekimsel kuvvetlerdir ve moleküller arasındaki r uzaklığıyla çok çabuk değişirler. Zayıf olmalarına karşın Van der Waals kuvvetleri sıvıların ve kimi katiların kohezyonunu sağlama gibi çok önemli bir rol oynarlar.
Kaynak: Büyük Larousse