Aktivasyon Enerjisi Nasıl oluşur ve etkileri nelerdir, Aktivasyon Enerjisi özellikleri nelerdir?
İki molekül arasında bir reaksiyon olabilmesi için bu moleküller temasa geldiklerinde, bunların eşik enerjisi denilen bir minumum enerjiye sahip olmaları gerekir. Bu enerjiye AKTİVASYON ENERJİSİ denir. Bu enerjiye sahip olan moleküllere de AKTİFLEŞMİŞ MOLEKÜL denir Bunların sayısı sınırlıdır.
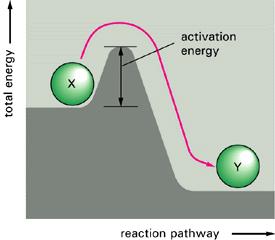
Reaksiyon hızına etki eden faktörlerden biri ak-tifleşmiş molekül sayısıdır. Eğer reaksiyonun aktivasyon enerjisi fazla ise, bu enerjiye sahip olan moleküllerin sayısı az olduğundan reaksiyon yavaştır; aksi halde hızlıdır. Aktifleşmiş moleküllerin sayısı aktivasyon enerjisitemparatürü artırmakla çoğaltılabilir. Gaz halindeki bir reaksiyon düşünelim. Bir gazın molekülleri devamlı bir şekilde hareket ve çarpışma halindedirler. Belli bir temparatürde moleküllerin Ek = V2 mv2 öteleme kinetik enerjilerinin Maxwel Boltzmann kanununa dağılımı şekilde görüldüğü gibidir.
Belli bir temparatürde (T,), bazı moleküller çok yüksek kinetik enerjiye sahiptir; çok yüksek enerjili moleküllerin sayısı ise pek azdır.Temparatür artırıldığında (T2 > T,) dağılım eğrisi, daha fazla sayıda molekülün daha yüksek kinetik enerjiye sahip olacak biçimde sağa kaymasına sebep olur. (T2 noktalı eğri) Böylece belli bir değerin üzerindeki kinetik enerjiye sahip möleküllerin sayısı artar.
Bir kimyasal reaksiyonun ancak E gibi belli bir aktivasyon enerjisinin üstünde bir enerjiye sahip iki molekülün çarpışması sonucunda meydana gelebileceğini düşünelim. Şekildeki eğrilerin altlarında kalan taranmış bölgeler bu E enerjisinden daha fazla enerjiye sahip olan moleküllerin veya atomların sayısı ile orantılıdır.
Düşük temparatürde bunların sayısı pek az olduğundan çarpışmaların pek azı etkin olacaktır. Bu nedenle reaksiyon yavaştır. Temparatür artınca, E enerjisinden daha fazlasına sahip olan moleküllerin sayısı artar. (T2 eğrisinin altında ve E doğrusunun ötesindeki taralı alan) Dolayısıyla reaksiyon hızı da artar. Temparatürün artması aynı zamanda çarpışma sayısının artmasına da sebep olur; fakat bu etki, reaksiyona sebep olan enerjiye sahip molekül sayısının artmasına sebep olan etki yanında çok küçüktür.
Bazı hallerde E aktifleşme enerjisi T eğrisinin maksimumuna yakın veya daha da solunda olabilir. Bu halde alçak temparatürde bile, yeterli enerjiye sahip moleküllerin sayısı çok fazladır; böyle moleküller arasındaki reaksiyonlara çok hızlı reaksiyonlar denir.