LİPAZ Yapısal Özellikleri ve Uygulama Alanları
Ticari enzimlere özellikle de mikrobiyal kaynaklı olan enzimlere olan ilgi pek çok alanda kullanıma sahip olmalarından dolayı gün geçtikçe artmaktadır. Enzimler tarafından katalizlenen reaksiyonlar kimyasal metotlara göre daha ucuz ve de daha basittir. Enzimler başta gıda, eczacılık, deterjan, tekstil ve kozmetik olmak üzere pek çok sanayi dalında yaygın olarak kullanılmaktadır. Amerika Birleşik Devletleri'nin 1995 yılındaki yaklaşık ticari enzim satış hacmi 1 milyon dolar olmakla birlikte bu rakamın 2005 yılına kadar ikiye katlanması beklenmektedir. Bu enzimlerin en az %75'lik kısmını hidrolazlar oluşturmaktadır ve bunların da %90'ı mikroorganizmalardan fermantasyon yolu ile üretilmektedir. Son on yılda mikrobiyal kaynaklı lipazın biyokatalitik potansiyelinin anlaşılmasından sonra, bu enzim de sanayide yaygın olarak kullanılmaya başlanmış ve böylece toplam satış hacminde üçüncü sırada yer almıştır.
Lipazlar (EC.3.1.1.3, triaçilgliserol açil hidrolaz) hayvansal ve bitkisel yağların normal koşullar altında tersinir hidrolizini katalizleyen enzimlerdir. Bunun dışında esterifikasyon, transesterifi- kasyon gibi reaksiyonları da katalizlemektedir. Bu enzim dünya çapındaki enzim satışlarının sadece %4'lük kısmına sahiptir. Burada lipazların ekonomik açıdan değerinin anlaşılamadığı bariz bir şekilde görülmektedir ve bu çalışmaların sanayiye yansıması için belirli bir süre gerekmektedir. Ayrıca enzimin maliyeti yüksektir. Enzimlerin sanayide kullanımının yaygınlaşmasını engelleyen en önemli nedenler ise düşük dayanım, aktivite ve seçicilikleridir. Bu sebeple, son yıllarda, lipazların hidroliz ve sentez reaksiyonlarındaki katalitik özelliklerinin geliştirilmesi için bazı kimyasal ve fiziksel işlemlere tabi tutulması gündeme gelmiştir. Buna ilave olarak moleküler biyoloji yolu ile enzimin maliyeti de düşürülebilir. Böylece de genetik özellikleri geliştirilmiş olan lipazın büyük miktarlarda üretimi sağlanabilir.
Lipazlar hayvansal, bitkisel ve doğal veya genetik olarak iyileştirilmiş mikroorganizmalardan elde edilebilir. Bunların arasından, kolay üretilmesi ve pek çok hidrolitik ve sentetik reaksiyonu katalizlemesinden dolayı en fazla kullanım bulan ise mikrobiyal kaynaklı lipazlardır. Lipaz tarafından katalizlenmiş olan reaksiyonlar doğal metabolik reaksiyonlara benzemesinden dolayı kimyasal reaksiyonlara oranla daha çevre dostu olarak tanımlanırlar. Düşük aktivasyon enerjileri sebebiyle lipazın katalizlediği reaksiyonlar daha düşük sıcaklık ve notral pH gerektirir, enerji gereksinimi düşüktür ve de ürün ve substratlara karşı aktiviteleri çok yüksektir ve bu aktivite özellikle de substrat (yağ)-su ara yüzeyinde en yüksek seviyeye çıkmaktadır. Bu kavram ara yüzey aktivasyonu olarak tanımlanabilir. Bu sebeple, en yüksek aktivitelere, substrat için yüksek yüzey alanına ulaşıldığı emülsiyon sistemlerinde ulaşılmaktadır.
LİPAZLARIN SINIFLANDIRILMASI
Enzimleri kimyasal reaksiyonlardan ayıran en önemli özellikleri seçicilikleridir. Lipazın seçicilik özelliği ise enzimin moleküler özellikleri, substratın yapısı ve enzimin substrata bağlanmasını etkileyen faktörler tarafından kontrol edilir. Lipazların yağ asidi seçiciliği, tıbbi gıdalar için yağ üretimi ve yağın besin değerini arttırmak için yağ asitleri ile zenginleştirmek için kullanılmaktadır. Lipaz spesifikliği üç temel grupta toplanır; pozisyon, substrat ve stereo seçicilik.
Bazı lipazlar yağ asitleri ile gliserid arasındaki bağları rasgele parçalar; gliserid molekülünün yerleşimi önemli değildir. Candida rugosa, Cory mebacterium acnes, Chromobacterium spp. Ve Staphylococcus aureus gibi mikroorganizmalardan elde edilen lipazlar bunlara örnek
olarak verilebilir. Posisyon seçiciliği olan lipazlar ise sadece sn-1,3 pozisyonundaki yani dıştaki ester bağlarını parçalar. Bu gruba örnek olarak ise Aspergillus niger, Mucor miehei, Rhizopus arrhizus ve Rhizopus delemar gibi organizmalardan elde edilen lipazlar verilebilir. Bazı lipazlar ise yağ asidinin zincir uzunluğuna göre seçicidir. Mesela, Penicil- lium cyclopium lipazı uzun zincirli yağ asitlerini parçalarken Aspergillus niger ve Aspergillus delemar lipazları ise kısa zincirli yağ asitlerine seçicilik gösterir. En son olarak ise yağ asidi seçici lipazlar yer alır. Bunlar ise cis-9 pozisyonuna duyarlıdır. Geotrichum candidum lipazı cis-9 pozisyonunda çift bağ içeren uzun yağ asitlerine seçicidir.
LİPAZ REAKSİYONLARI Diğer hidrofilik enzimlerde olmamasına rağmen farklı kaynaklardan elde edilen lipazlar polar olmayan organik çözgenler içinde dayanıklıdır ve farklı boyutta ve özellikteki oldukça fazla sayıda substratı kabul edebilir. Bunların esnek protein yapıları onlara hidroliz, interesterifikasyon, transesterifikasyon (asidoliz, interesterifikasyon, alkoliz), aminoliz, oksimoliz ve tiotransesterifikasyon gibi pek çok reaksiyonu katalizleme olanağı verir. İleri (hidroliz) ve tersinir (sentez) reaksiyonlar, reaksiyon karışımının su aktiviseti ile kontrol edilir.
Lipaz enziminin su kullanarak triaçilgliserolün ester bağlarını bölmesi olayına hidroliz denir. Amerikan yağ sanayinde Colgate-Emery prosesi yağların parçalanması amacı ile kullanılmaktadır. Bu proses aşırı basınç ve sıcaklıkta gerçekleştiği için yağ yapısında bozulmaya yol açar. Ayrıca maliyeti de oldukça yüksektir. Bu sebeple, yağ sanayinde lipaz enziminin kullanımı daha uygundur. Bu teknoloji günümüzde yağ asidi, digliserid, monogliserid üretimi, süt ürünleri ve deterjan imalatında uygulanmaktadır.
Esterifikasyon hidroliz olayının tersidir ve düşük su aktiviteli sistemlerde gerçekleşir. Transesterifikasyon ise açil radikallerinin bir ester ve bir asit (asidoliz), bir ester ve diğer bir ester (interesterifikasyon) veya bir ester ve bir alkol arasında değişimi olarak tanımlanabilir. Aşağıdaki şekilde lipaz tarafından katalizlenen tüm reaksiyonlar toplu olarak görülebilir.
GIDA SANAYİNDE LİPAZLAR
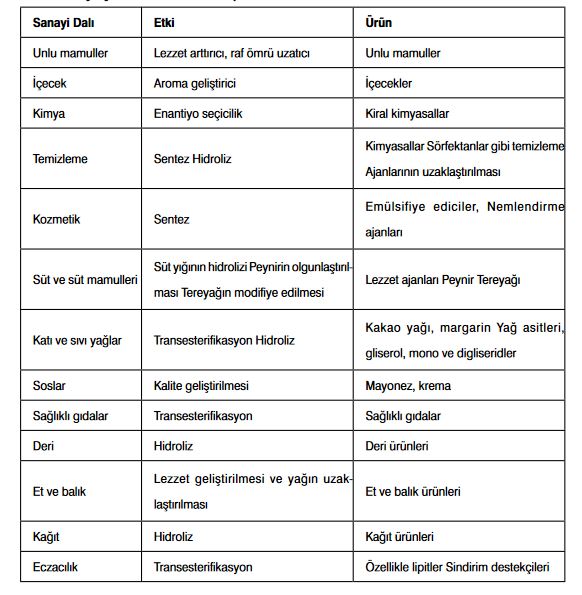
Lipaz enzimi gıda sanayi de dahil olmak üzere pek çok sektörde kullanıma sahiptir. Bu enzimin kullanım alanları Tablo 1'de verilmiştir.
Son yıllarda doğal ürünlere olan ilginin artmasıyla birlikte gıda sanayinde geleneksel kimyasal işlemler yerine enzimlerin kullanımı gündeme gelmiştir. Günümüzde lipazlar peynir, tereyağı, sos ve çorba gibi birçok ürünün üretiminde oldukça yaygın bir şekilde kullanılmaktadır. İtalyan peynirlerinde tadın oluşturulması, Çedar peynirinde olgunlaştırmanın hızlandırılması ve işlenmiş mavi peynirde tadın iyileştirilmesi işlemleri lipaz enziminin yardımlarıyla gerçekleştirilir. Lipaz ilavesi ilk olarak kısa-zincirli (C4 C14) yağ asitlerinin salınmasıyla birlikte sabunsu tadın elde edilmesine yol açar. Lipazla kısmen hidrolize edilmiş tereyağı, zenginleştirilmiş kaymaksı tada sahip olup, patlamış mısır, sıvı yağlar, katı yağlar, tahıllar, şekerlemeler, tüketime hazır gıdalar ve unlu mamuller gibi çeşitli gıda maddelerine eklenmektedir.
Lipazla modifiye edilmiş kremalar, kahve beyazlatıcılarına, şekerlemelere, hamurlara, çorbalara ve unlu mamullere süt tadı katması amacı ile ilave edilmektedir. Süt yağlarının hidrolizi de lipaz tarafından kontrol edilmektedir. Lipaz kullanımına yer veren süt sanayinde, lipaz konsantrasyonu, pH, sıcaklık ve emülsiyon miktardının belirli değerlere ayarlanması spesifik yağ asitlerinin kontrollü salınmasına izin vermektedir. Alışılagelen kimyasal interesterifikasyon işlemiyle yapılması mümkün olmayan bu işlem, aynı zamanda kötü tat oluşturan spesifik yağ asitlerinin de en aza indirilmesini sağlar. Ayrıca farklı kaynaklardan elde edilen lipazlar farklı özellikler ve seçicilik gösterdiğinden, istenilen özellikte ürün elde etmek için lipaz tipinin seçimi çok önem taşımaktadır. Süt yağı besinsel yağların çok önemli bir kaynağı olmakla birlikte, yüksek oranlarda kolesterol ve koroner kalp hastalıklarının artmasının sebebi olarak gösterilen birincil doymuş yağ asidi kalıntıları ihtiva etmesi sebebiyle birkaç yıldır sağlık açısından zararlı olarak görülmektedir. İnsan diyetindeki doymuş asitlerden kaynaklanan sağlık sorunlarının başlıca sorumluları laurik, miristik ve palmitik asitlerder. Bunların tam tersine oleik asit (C18: 1), kandaki kolesterol miktarını azaltmaktadır. (Balcao ve malcata, 1998). Bu nedenle, tada yaptığı etkilerin yanında lipaz, yağ asidi kombinasyonlarının değiştirilmesi ve bu yolla besinsel kalitesinin arttırılması amacıyla süt yağının işlenmesinde kullanılmaktadır.
Lipaz tarafından katalizlenmiş ester sentezinin piyasada tat verici esterlere giderek artan talebi karşılayabileceği düşünülmektedir. Bunlardan bir tanesi ananas ve muz gibi doğal meyve aromalarına sahip olan etil bütirat olup gıda sanayinde lezzet arttırıcı olarak yaygın bir şekilde kullanılmaktadır. (Chen, 1996). Kısa bir süre önce, lipazm gıdalarda bozulmaya yol açan mikroorganizmaların ve bazı gıda toksinlerinin hızlı tespitinde bir indeks olarak kullanılabileceği keşfedilmiştir. Ayrıca bir başka çalışmada lipazların, gıdaların çürümesine yol açan psikotrof organizmaların üzerindeki etkisine ve bunların kontrolünde kullanılabilirliğine yer verilmiştir.
Bir trigliseridin pozisyonu, zincir uzunluğu ve doymamışlık derecesi yalnızca fiziksel özelliklerini etkilemekle kalmayıp aynı zamanda besinsel ve duyusal değerlerini de etkilemektedir. Palmitik ve stearik asitleri bünyesinde bulunduran kakao yağının erime noktasının yaklaşık 37 C° dir. Bu sebeple ağza alınması ile birlikte erir ve bir serinlik duyusunun algılanmasına sebep olur. 1976'da Unilever adlı firma immobilize lipaz kullanmak suretiyle yaptığı bir dizi hidroliz ve sentez reaksiyonları sonucunda kakao-tereyağı yerine geçen bir madde üretmiş ve bunun patentini almıştır.
Lipaz Kaynaklari
Biyolojik olarak aktif enzimler herhangi bir canli organizmadan elde edilebilirler. Ticari amaçli enzim üretiminde kullanilan kaynaklar çok genis çaptadir. Endüstride kullanilan enzimlerin büyük çogunlugu mantar ve maya, % 13 bakteri, % 4 bitki, % 8 hayvan kaynaklidir. Günümüzde enzim kaynagi olarak mikrobiyal kaynaklar, mikrobiyal olmayanlara tercih edilmektedir çünkü;
- Genellikle üretimleri daha ucuzdur.
- Enzim içerikleri daha kontrol edilebilir ve daha tahmin edilebilirdir.
- Bitki ve hayvan kaynakli enzimlere göre daha karali yapida enzim elde edilmektedir.
- Kullanilacak hammadde ve araç gereci saglamak kolaydir.
- Hayvansal ve bitkisel dokular sagliga zararli materyaller içerebilirler (Bitkiler fenolik bilesikler içerirler).
Bitki ve hayvan kültürleri kullaniminda karsilasilan zorluklardan dolayi mikrobiyal kaynaklar tercih sebebi olmaktadir. Mikrobiyal enzimlerin büyük bir çoğunluğu kisitli sayida türden elde edilmektedir.
Fungal lipaz kaynagi olarak; Rhizopus, Aspergillus, Penicillium, Mucor, Geotrichum, Humicola, Fusarium, Rhizomucor, Mucor, Ashbya, Beauveria, Acremonium, Alternaria cinslerine ait türler kullanilabilmektedir.
Lipaz kaynagi olarak kullanilabilen mayalar ise; Candida, Yarrowia, Rhodotorula, Pichia, Saccharomyces, Torulaspora, Trichosporondur.
LİPAZIN ÜÇ BOYUTLU YAPISI
Tüm kaynaklardan elde edilen lipazların üç boyutlu yapıları hemen hemen birbirine benzemektedir. 1990 ile 1995 yılları arasında 11 değişik lipaz türünün yüksek çözünürlükteki yapısı çözülmüştür. Burada boyut, sıralama benzerliği, substratlar ve aktivatörler dışında çoğunluğunun benzer yapıya sahip olduğu gözlenmiştir. Günümüze kadar yapılan çalışmalarda tüm lipazların karakteristik olarak katalitik grupları içeren merkezi bir p-bandı ile a/p hidrolaz yapıdaki proteinlerin iç yapısı incelendiğinde ise paralel p kıvrımlı bantların heliks şeklindeki a yapıları ile ayrıldığı ve süper heliksel olarak gönmüş bir şerit şeklini aldığı görülmüştür. Heliks yapısındaki peptit kısımları ise bu şeridin dış kısımlarında yer almıştır.
Lipazlar genel olarak C ve N olmak üzere iki kısma ayrılmış bir polipeptit zincirinden oluşmaktadır. Bunlardan N- kısmı katalitik serinden yüzeye kadar üzanan ve uzun bir yağ asidi zinciri taşıyan bir hidrofobik tünel ile aktif merkezi kapsamaktadır.
Bu gruptaki enzimlerin farklı seviyelerdeki benzerliklerinin dışında bir sıralama istisnai olarak sıkça gözlenmiştir; pentapeptit Gli-X-Ser-X-Gli. Bu serin amino asidinin yapıda korunması ve bunun değişime uğraması veya yer değiştirmesi ile katalitik aktivitenin yitirilmesi bu amino asidin kataliz için çok önemli ve gerekli olduğunu göstermiştir. Bunun topografik yerleşimi de korunmuş ve belirgindir; protein zincirinin gergin bir bölümünün en üstünde bulunmaktadır. Fakat bu gergin bölümün serin amino asidine yakın -2 ve +2 pozisyonlarındaki amino asitlerinin küçük yan zincir gruplar içermesi mecburidir.
Katalitik serin amino asidine ilave olarak çoğu lipazın aktif merkezi histidin ve başka bir amino asit (Asp veya Glu) daha içerir. Nükleofilik serin bir p-bandı ile a-heliksinin arısnad yer alırken histidin, aspatik asit ve glutamik asit ise serinin diğer yanlarında yer alır. Katalitik bölgeyi içeren amino asitler çoğu lipaz yapısında korunur.
Lipazlar için tahmin edilen katalitik mekanizma aktif merkezde bulunan serin ami- noasidi üzerinde yoğunlaşmıştır. Serinin mükleofilik oksijeni trigliserid ile tetrahedral hemiasetal bir ortam oluşturur. Hemiasetalin ester bağı hidroliz olur ve diaçilgliserid
serbest kalır. Aktif merkezdeki serin açil esterinin bir su molekülü ile tepkimeye girdiği, daha sonra açil enzimin bölündüğü ve yağ asidinin ayrıldığı tahmin edilmektedir. Katalitik prosesin bu aşamasında ürünün aktif merkezden ayrılması özellikle önem taşımaktadır.
Gıda Mühendisliği Dergisi Derlemedir