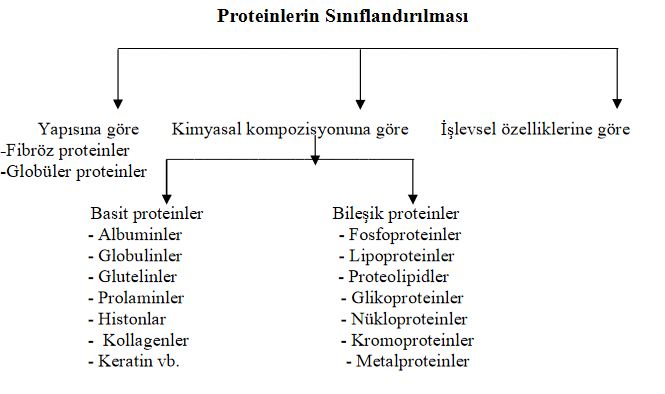
Proteinlerin Sınıflandırılması
Yapısına Göre Proteinler
Proteinler konfigürasyon tipine göre; fibröz ve globüler olmak üzere ikiye ayrılır.
Suda çözünmezler. Bir eksen boyunca uzanmış bir polipepetid ya da birbirine paralel olarak yerleşmiş polipeptid zincirlerinden ibaret çubuk şekilli proteinlerdir.
Büyük bir kısmı sulu sistemler de çözünebilir. Bunlar toplu halde ve hemen hemen yuvarlak bir yapıdadır. Enzimler, hormonlar vb. proteinler globüler karakterdedir
Kimyasal Kompozisyonlarına Göre Proteinler
Proteinler kimyasal kompozisyonlarına göre basit ve bileşik proteinler olarak ikiye ayrılabilirler. Burada çözünürlük özelliği sınıflamada temel olarak görev üstlenmektedir.
Basit Proteinler
Hidrolize olduklarında yalnızca aminoasitleri ve türevlerini veren proteinlerdir. Başlıca basit proteinler şunlardır:
Suda çözünürler. Çoğunlukla globulinlerle birlikte bulunurlar. Globulinlerden farkı suyun yanı sıra seyreltik asitlerle de çözünebilmesi ve amonyum sülfat ile doyurulduğunda çökelme özelliği göstermesidir.Yüksek sıcaklıklarda koagüle olurlar (pıhtılaşırlar). Glisin içermezler ancak kükürtçe zengindirler. İçinde bulundukları çözelti (NH4)2SO4 (amonyum sülfat) ile doyurulduğunda çökerler. Albuminler hayvanlar ve bitkiler de bulunmakta ve değişik isimlerle anılmaktadır. Serum albumini kan serumunda, laktoalbumin sütte, ovoalbumin yumurta akında, legümelin mercimekte, löykozin buğdayda, bir hormon olan insülin ise pankreas salgısında bulunan albuminlerdir.
Saf suda çözünmezler. Buna karşılık seyreltik (NH4)2SO4 ve diğer nötral tuz çözeltilerinde çözünme eğilimindedirler. Bazı globulinler, seyreltik nötral tuz çözeltilerine su eklenmesi veya çözeltinin asitlendirilmesi ya da CO2 ile muamelesi sonucunda çökelirler. Globulinler (NH4)2SO4 ile yarı yarıya doyurulduklarında çökelirler. Bu özellikten yaralanılarak, globulinler aynı ortamda bulunan albuminlerden kolayca ayrılabilmektedir. 60-70 °C arasındaki sıcaklıklarda koagüle olurlar. Bitkilerde depo protein olarak önemli fonksiyonları vardır. Hayvansal kaynaklarlarda da sık olarak rastlanan bir protein tipidir. Zayıf bir asit karakter gösterir. Bu özellik yapılarındaki monoamino dikarboksilik aminoasitlerden kaynaklanmaktadır. İzoelektrik pH noktaları 5-6dır. Ovoglobulin yumurta sarısında, fasolin beyaz fasulyede, legümin mercimekte, edestin buğdayda, avenalin yulafta, laktoglobulin ise sütte bulunan globulinlerdir.
Bitkisel proteinlerdir ve gliadinlerle birlikte tahıllarda yer alırlar. Su ve tuz çözeltilerinde çözünmezler. Yüksek sıcaklıklarda koagüle olurlar. Hububatlardan seyreltik asitler veya bazlardan yararlanılarak ekstrakte edilebilirler. Bunu yanı sıra, çok az miktardaki (NH4)2SO4 ile hazırlanmış alkali ekstraklarından tuz halinde de ayrılabilirler. Gliadinlerin aksine lizin ve triptofan içerirler. Bu nedenle de tamamlayıcısı durumundadırlar ve birlikte ekmek kalitesini olumlu yönde etkilerler. Glutenin buğdayda, hordenin arpada, orizenin pirinçte, zeanin mısırda, avenin yulafta, sekalinin çavdardaki gluteninlerdir.
- Prolaminler (gliadinler, alkolde çözünen proteinler, taneli bitki globulinleri)
Bir grup bitkisel globulinlerdir. Tahıllardan yalnız pirinçte bulunmaz. Genellikle tohumlarda bulunan bitkisel proteinlerdir. Saf alkolde ve suda çözünmezler. Ancak unlardan %50-90lık alkolden yararlanılarak ekstrakte edilebilirler. Bol miktarda prolin içerirler ve asit hidrolizinde amonyak oluştururlar. Bu nedenlerle prolaminler olarak adlandırılmaktadırlar. Bol miktarda glutamik asit içerirler. Yapılarında lizin yoktur, bunun ancak arjinin ve histidin içeriğinin çok az oluşu bu proteinlerin düşük bir biyolojik değere sahip olmasına neden olmaktadır. Çölyak (coeliac) hastalığı gliadine karşı gelişen intoleranstan kaynaklanmaktadır. Gliadini uzaklaştırılmış ürün oluşturulması hastalığın tedavisinde önem kazanmaktadır. Buğdaydaki glutenin ile birlikte gluten kompleksine katılırlar ve bu durum ekmek kalitesini belirler. Zein mısırda, gliadin buğdayda, hordein arpada, sekalin çavdarda, orizin pirinçte, kafirin darıda bulunan prolaminlerdir.
- Protaminler (büyük peptidler)
En basit proteinlerdir (yapısında 14-20 peptid bağı vardır). Kuvvetli baziktirler. Hidrolize olduklarında bazik aminoasitleri özellikle arjinin, histidin ve ornitini verirler. Arjinin baskın hidroliz ürünüdür. Kükürtlü ( sistin ve sistein ) aminoasitleri içermezler. Pepsin dışındaki diğer birçok sindirim enzimleriyle hidrolize olurlar. Su, seyreltik amonyak, asit ve baz çözeltilerinde çözünürler. Yüksek sıcaklıklarda koagüle olmazlar. Bu proteinler yalnız bazı balık cinslerinde bulunur.
Yapılarında bazik aminoasitler yoktur, suda ve çok seyreltilmiş asitlerde çözünürler. Isı ile koagüle olmazlar.
Gıda sanayinde jelatin yapımı için önemlidirler. Suda çözünmezler. Sindirim enzimlerinden etkilenmezler. Bağ doku, kemik, kıkırdak vb yerlerde bulunurlar. Kaynar suda veya seyreltik asit ve alkaliler de kaynatılırsa suda kolayca çözünen jelatin elde edilir.
- Keratin, fibrin, miyosin, elastin ve epidermin
Bu proteinler suda çözünmez veya çok zayıf bir çözünürlük gösterir. Aynı şekilde asitler ve bazlar da çözünme özellikleri zayıftır. Seyreltik asitlerle ıs ıtılsa dahi çok yavaş çözünür ve jelatin oluşumuna neden olmaz. Keratinler çok miktarda sistin içerir (%17den fazla). Özellikleri kollajenlere benzer ve saç, tırnak, yün, boynuz ve tüylerin yapıtaşıdır. Fibrin, kan serumunda bulunan ve kan pıhtılaşmasında etken olan bir fibröz proteindir. Miyosin kas hücresi içinde bulunur ve sindirimi kolay bir proteindir. Elastin bir çeşit kollajendir ve elastik bağ dokusunda bulunur. Kaynatma sonucunda jelatine dönüşmez. Epirdemin ise deride bulunan bir fibröz proteindir.
Bileşik Proteinler (Konjuge Proteinler, Proteidler, Heteroproteinler)
Basit protein ve buna zayıf veya çok sağlam bir şekilde bağlanmış protein olmayan bazı maddelerden kurulmuşlardır. Hidroliz edildiklerinde aminoasitlere ek olarak bileşik proteinin cinsine göre nükleik asit, karbonhidrat, fosforik asit ve lipit gibi maddeler verir. Başlıca bileşik proteinler şunlardır;
Prostetik grubu fosforik asit olan proteinlerdir. Fosforik asit içeriği proteine asit karakter verir. Fosfoproteinler seyreltik alkaliler ile amonyakta çözünür ve tuz oluşturur. Asitleştirme sonucunda çökelir. Suda hemen hemen hiç çözünmez. Fosfoproteinlere en iyi örnek süt proteini olan kazeindir. Kazein nötral koşullarda ısıtıldığında koagüle olmaz ancak sütün asitleştirilmesiyle birlikte koagülasyon görülür. Rennet koagülasyonunda kalsiyum kazeinat çözünmez özellikteki parakazein ile çözünür karakterdeki makropeptidlere dönüşür. Ovaviletin, yumurta sarısındaki fosfoproteindir ve yumurta sarısında lesitin ile birlikte bulunur. Bu protein yumurtanın fosfor içeren önemli bir yedek maddesini oluşturur. Lesitin ile yapmış olduğu kompleks ancak denatürasyon koşulları oluştuğunda birbirinden ayrılır.
Lipoproteinler lipit-protein kompleksleridir. Proteinleri çözünme özelliklerine sahiptirler. Lipoproteinler hücre zarında, yumurta sarısında ve kanda bulunur.
Proteolipidler, lipit-protein kompleksleridirler. Lipidlerin çözünürlük özelliklerine sahiptirler. Miyelin sinir hücresinde, lipovitelenin ise yumurta sarısında bulunan bir proteolipittir.
- Glikoproteinler ve mukoproteinler (mukoidler)
Basit proteinlerle karbonhidratların yaptığı komplekslerdir.Hidroliz sonucu amino şekerleri verir. Glikoproteinler deride, kıkırdakta, kemiklerde, bağ dokuda, yumurta akında, kan serumunda, idrarda, tükürükte, mide sıvısında, gözde, vb. yerlerde bulunur. Ayrıca bakterilerin hücre duvarında da yer almaktadır. Mukoproteinler genellikle mukoz (yapışkan) yapıdadır ve daha çok ağız, burun, nefes borusu ve mide gibi organların mukoz membranları ve sıvılarında bulunurlar.
Nükleik asitlerle (DNA veya RNA) bazik asit proteinlerin (protaminler veya histonlar) yaptıkları tuzlardır. Bunlar prostetik grubu nükleik asit olan bileşik proteinledir. Önemli miktarda fosfat içerdiklerinden asidiktir.Hücre çekirdeğinin temel elemanıdır.
Kromoproteinler prostetik grubu düşük molekül ağılıklı pigment veya pigment benzeri maddelerdir ve prostetik gruplar çoğu kez bir metal (Fe, Mg) içerir.
Örnek olarak; hemoglobin (Kanın prostetik grubu kandır.Bunun çekirdek kısmında Fe yer alır), bitkilerdeki kloroplastin (prostetik grubu klorofildir ve çekirdek kısmında Mg yer alır) myoglobin (kas pigmenti ), sitokromlar, sitokrom oksidazlar, katalaz ve peroksidaz gösterilebilir.Flavoproteinler prostetik grup olarak riboflavin içeren bir protein grubudur.
Prostetik grup olarak metal bağlanmış proteinlerdir. Metalloproteinlere tirosinaz (bakır) ve ksantinoksidaz (molibden) enzimleri örnek gösterilebilir.
İşlevsel Özelliklerine Göre Proteinler
Fonksiyonlarına göre proteinler; enzimler, yapısal proteinler, kontraktil proteinler (myosin, aktin, tubulin), hormonlar (insulin, büyüme hormonları), transfer proteinleri (serum albumini, transferin, hemoglobin), antikorlar (immünoglobulinler), depo proteinleri (yumurta albumini, tohum proteinleri) ve koruyucu proteinler (toksinler, alerjenler) şeklinde de sınıflandırılabilir.
Proteinlerin Bazı Fiziksel ve Kimyasal Özellikleri
Proteinlerin Molekül Ağırlıkları
Proteinler yüksek molekül ağırlıklarına sahip bileşiklerdir. Proteinlerin molekül ağırlıkları çeşidine göre değişmektedir.
Proteinler, sahip oldukları moleküler yapının büyüklüğü nedeniyle kolloidal özellik gösterir. Proteinlerin molekül ağırlıklarının belirlenmesinde çeşitli yöntemler kullanılmaktadır. Bunlardan en önemlisi ultrasantrifüj yöntemidir.
Proteinlerin İyonlaşma Özelliği
İyonlaşabilen fonksiyonel grupların pek çoğu yan zincirlerden kaynaklanmaktadır. Proteinin kendine özgü bir izoelektrik pH noktası vardır. Bu noktada proteindeki pozitif ve negatif yüklerin toplamı kesinlikle birbirine eşittir ve net yük sıfır, toplam yük ise maksimumdur. Toplam yük proteindeki bütün pozitif ve negatif yüklerin toplamı, net yük ise pozitif ve negatif yüklerin farkıdır. Ortam pHnın düşmesi veya yükselmesi, net yükü maksimuma doğru artırma eğiliminde iken toplam yük daima izoelektrik noktadan daha düşük olur.
Proteinler iyonlaşmada yalnızca proton alıp vermemekte, diğer iyonlar da bu yönde reaksiyona girmektedir. Bu nedenle de proteinlerin birbirlerinden farklı birer izoelektrik nokta ve izoiyonik noktaları bulunmaktadır. İzoiyonik nokta; H+ ve OH" dışında hiçbir iyon bulunmayacak derecede sonsuz dilüsyonu (seyreltme ) yapılmış protein çözeltisinin pHsı olarak da tanımlanmaktadır. Bu durumdaki proteinlerin çözünürlüğü izoelektrik noktada en düşük düzeydedir ve proteinler bu noktada çözelti içinde çökme eğilimindedir ( izoelektrik noktada çökelme ).
Proteinlerin Çözünürlük Özelliği
Proteinlerin çözündüğü ortamlar genellikle su, gliserol, dietilformamit, dimetilformamit veya formik asit gibi kuvvetli polar çözücülerdir. Çözünürlük protein yapısındaki hidrolik (polar) ve hidrofobik (apolar) gruplara bağlı olarak değişmektedir. Prolaminler gibi sınırlı sayıdaki bazı proteinler düşük düzeyde polar olan etil alkol gibi çözücülerde çözünebilmektedir.
Proteinlerin çözünürlük karakteristiklerini etkileyen başlıca interaksiyonlar (etkileşimler) hidrofobik ve iyonik yapılardır. Bunun bir sonucu olarak hidrofobik interaksiyon protein-protein etkileşimini oluşturur ve sonuçta çözünürlüğün azalmasına yol açar. Buna karşın iyonik interaksiyon protein-çözücü etkileşimini sağlayarak sonuçta çözünürlüğün artmasına yol açar.
Proteinlerin sudaki çözünürlüğü pH ve tuz konsantrasyonuna bağlı olarak değişebilmektedir. Amonyum sülfat gibi nötral tuzlar protein çözünürlüğü üzerinde iki farklı etkiye sahiptir. Bu tuzlar düşük konsantrasyonlarda elektrostatik protein-protein etkileşimini (bağlama gücünü) önleyerek, proteinin çözünürlüğünü artırmaktadır (salting-in etkisi). Buna karşılık yüksek nötral tuz konsantrasyonlarında, tuzdaki iyonların hidrasyon eğilimi nedeniyle protein çözünürlüğü azalmaktadır (salting-out etkisi). Proteinlerin çözünürlük karakteristiklerini etkileyen başlıca interaksiyonlar hidrofobik ve iyonik yapılardır. Bunun bir sonucu olarak hidrofobik interaksiyon protein-protein etkileşimini oluşturur ve çözünürlüğün azalmasına yol açar. Buna karşın iyonik interaksiyon protein-çözücü etkileşimini sağlayarak çözünürlüğün artmasına yol açar.
Proteinler polar bileşiklerdir ve bu nedenle de su içinde hidrate olur. Hidrasyon derecesi (g hidrasyon suyu/g protein) proteinden proteine göre değişmektedir. Çözünürlük özelliği göstermeyen proteinlerin şişmesi, çözücü proteinlerin hidrasyonuna karşılık gelir. Bunun bir sonucu olarak peptid zincirleri arasına su molekülleri girerek hacmin artmasına ve diğer bazı fiziksel özellikler de değişimlere yol açar. Şişme sırasında alınan su, proteinin kuru ağırlığının birkaç kat artmasına neden olur. Proteinlerin çözünürlüğü üzerine çözücünün pHsı, iyonik kuvvet, sıcaklık ve organik çözücünün varlığı gibi faktörler de etkilidir.
Proteinlerin Çökelme Özellikleri
Proteinler bir çözücü içinde yük ve protein-çözücü etkileşimi tarafından kararlı bir durumda tutulur. Bu kararlı durum proteinin yapısında bulunan aminoasitlerin ve çözücü sistemin özelliklerine göre değişir. Kararlı durumu oluşturan etkenlerden biri ortadan kalkarsa protein bazen çökelir, ikisi de ortadan kalkarsa protein daima çökelir.
Proteinlerin izoelektrik noktada (pH) çöktürülmesi
Proteinler aminoasitler gibi amfolit karakterdedir. Asit çözeltilerde karışık katyonlar halinde bulunur.
Proteinlerde aminoasitler gibi izoelektrik noktalarında çok düşük çözünürlük özelliği gösterir. Proteinin izoelektrik nokta pHında, yüksüz olup elektriksel bir alanda kutuplara hareket edemez durumdadır.
Sütte yer alan kazein gibi bazı proteinler, çözelti pHının bu proteinin izoelektrik noktasına girilmesiyle kolayca çökeltilir. Bu özellikten süt endüstrisinde fermente süt ürünlerinin elde edilmesinde yararlanılmaktadır. Diğer taraftan protein çözeltileri çok iyi tampon özelliği gösterdiklerinden gıda endüstrisinde bu alanda da yararlanılmaktadır.
Ağır metal ve tuzları ile çöktürme
Hg+2, Pb+2, Cu+2,Ag+, Au+, Pb+4 gibi pozitif ağır metal iyonları ve bunların tuzları (HgCl2, kurşun asetat vb) bazik koşullarda proteinleri çökeltirler. Bu iyonlar, proteinlerdeki - SH ( sülfidril ) grupları ile sülfitleri oluşturduklarından proteinlerin denatürasyonuna neden olur.
Asit ile çöktürme
Hidroklorik, sülfirik, nitrik ve asetik asit gibi asitler, sulu çözelti halinde proteinleri çöktürürler. Çöktürme işlemi, ısıl işlemlerle daha da hızlandırılabilir. Bu tip çöktürme, pHdaki hızlı değişim nedeniyle proteinlerin denatürasyonu ile sonuçlanır. Konsantre asitler kullanıldığında tam bir denatürasyon görülür.
Nötral tuzlarla çöktürme
Sulu protein çözeltilerine amonyum sülfat, sodyum sülfat veya alkali fosfat karışımları gibi nötral tuzların eklenmesi sonucu proteinler çökelir. Yüksek tuz konsantrasyonu protein molekulünün etrafındaki su moleküllerine etki ederek çözünürlükten sorumlu elektrostatik güçleri değiştirir. Tuz ile çöktürme ortamın pH ve tuz konsantrasyonundan önemli derecede etkilenir. Çökelme en etkin birimde proteinin izoelektrik noktasında gerçekleşir. Proteinlerin nötral tuzlarla çöktürülmesi denatürasyona neden olmaz.
Organik çözücülerle çöktürme
Sulu protein çözeltilerine etil alkol ve aseton gibi bazı organik çözücülerin eklenmesi proteinleri çökeltir Çökelme, proteinin izoelektrik noktasında çok kolay olur. Organik çözücülerle çöktürme de genellikle denatürasyon görülmez. Ancak çöktürmenin 0°C'de yapılması önerilmektedir.
Protein Denatürasyonu ve Koagülasyonu
Proteinlerin sekonder ve tersiyer yapısını oluşturan bağlar bazı koşullarda parçalanarak üç boyutlu yapının bozulmasına neden olur. Denatürasyon sırasında kovalent bağlar korunur. Ancak disülfit bağları kırılarak çok sayıda sülfidril grubu açığa çıkarır. Yani molekül yumak şeklini koruyamayıp açılmaya, düz şekil alamaya başlar. Bu durum ise denatürasyon olarak tanımlanır. Proteinlerin denatürasyonunu tetikleyen etmenler ısıl
işlemler, radyasyon, çeşitli kimyasallar, asidik, bazik çözeltiler, konsantre tuz çözeltileridir. Denatüre proteinler bazı fiziksel ve kimyasal özelliklerini kaybederler. Ancak peptid bağlarına hala sahip olup besin değerini kaybetmez.
Denatürasyon olayı proteinlere has ve proteinlere farklı derecelerde etkili olan bir olaydır. Dondurulmuş gıdaların çoğunda proteinler kısmen denatüre olur ve dengeleri bozulur. Balık proteinlerinde dondurulduktan sonra balık etinin daha sert ,lastiğimsi ve susuz olması gibi sonuçlar ortaya çıkar. Süt kazeini ise dondurularak saklanan sütlerde kısmen denatüre olarak daha dengesiz hale gelir.
Protein denatürasyonu sonucunda; - Proteazların protein yapısı üzerine etkisi azalır,
- Viskozite artar,
- Çözünürlük azalır,
- Enzimler ve toksinler aktivitelerini kaybederler,
- Su bağlama kapasitesi azalır,
- Rotasyon ve difüzyon stabilitesi değişir,
- Protein kristalizasyonu önlenir.
Disülfit bağlarının kırıldığı ve konformasyon değişikliklerinin olduğu denatürasyonlar tersinmezdir. Proteinler kuru ortamlarda ısıl denatürasyona daha dirençlidir. Ortamda suyun bulunması denatürasyonu kolaylaştırır ve sıcaklıktaki her 10 °Clik artış denatürasyon hızını iki katına çıkarır. Bazı proteinler soğuk uygulamalarında aktivitelerini kaybeder.
Parçalama, yoğurma, çırpma gibi mekanik işlemlerde proteinler hava-sıvı yüzeyi arasına hapsolur ve buradaki enerji kitle fazın enerjisinden fazla olması proteinlerde konformasyonel değişime neden olur. Esnek olan proteinler diğerlerine göre daha kolay denatüre olur.
Proteinlerin çözünemez duruma gelmesine neden olan değişiklikler ise koagülasyon olarak adlandırılır. Denatürasyonla, parçalanan peptid zincirleri arasındaki -H bağları ve -S- S- bağlarının -SH gruplarına dönüşmesi ile ileri aşamalara gelmiş ise proteinin yapı ve özelliklerinin değişmesi geri çevrilemez durumdadır. Protein yapıları iyice açılır,yan zincirler bir araya toplanır ve büyüyen protein çöker. Örneğin, yumurta veya hamur pişirilince koagülasyon olayı gerçekleşir ve bu olay geri dönüşümsüzdür.
Proteinlerin İşlevsel Özelikleri
Bir gıdanın tüketici açısından önem taşıyan işlevsel özelliği, gıdanın enerji besin ögesi değerinin dışındaki diğer yararlılıklarına yönelik niteliklerinin tümüdür. Bunlar sırasıyla yapı tat-koku, renk ve görünüştür. Bu işlevsel özelliklerin büyük bir bölümü duyusal özelliklere, bir kısmı da fiziksel yapıya yönelik olup bunların tümü gıda hazırlama, üretim ve depolama sonuçlarını göstermektedir. Bu özellikler üzerine proteinlerin taşıdıkları fizikokimyasal nitelikler etkili olup gıdalara bazı arzu edilen özelliklerin kazandırımasını sağlarlar. Örneğin; fırıncılık ürünlerinin taşıdıkları bazı duyusal özellikler buğday glüteninin hamur oluşumundaki etkisi ve viskoelastik karakteri ile ilgilidir. Etin körpe ve sulu yapısı büyük ölçüde kastaki aktin miyosin ve aktomiyosin gibi suda çözünür proteinlerden kaynaklanmaktadır. Bazı süt ürünlerinin gösterdiği yapı ve pıhtı oluşturma özelliği kazein misellerinin kolloidal karakteristiği ile ilgilidir. Proteinlerin işlevsel özelliklerini ortaya çıkaran faktörler onların taşıdığı bazı fiziksel, kimyasal ve fizikokimyasal yapılarından kaynaklanır. Bunlar sırasıyla proteinlerin boyutlari, şekilleri, aminoasit kompozisyonu ve dizilimi, net yük ve elektrik yükü dağılımı, hidrofobite/hidrofilite oranı, ikincil, üçüncül ve dördüncül yapı, moleküllerin esneklik/sertlik durumu ve diğer moleküllerle interaksiyon yeteneği gibi noktalardır. Ancak her bir özelliğin, her bir işlevsel özellikteki yerini tayin etmek oldukça güçtür.
Hidrasyon özellikleri
Bilindiği gibi sulu çözeltide yer alan bir proteinin bireysel dizilimi büyük ölçüde su ile olan interaksiyonuna bağlıdır.
Su molekülleri protein yapısındaki ceşitli grupları bağlayabilir. Su proteinlerin fizikokimyasal özelliklerini modifiye eder.
Bilindiği gibi proteinlerin dispersiyon, nemlilik, şişme, çözünürlük, viskozite, su- tutma kapasitesi, jelasyon, koagülasyon, emülsiyon ve köpürme gibi işlevsel özellikleri su- protein interaksiyonuna bağlıdır.
Proteinlerin hidrasyon yeteneğini protein konsantrasyonu ve konformasyonu, pH, sıcaklık, zaman, iyonik kuvvet ve ortamda bulunan diğer komponentlerin (protein-protein yada protein-su) arasındaki kuvvet etkiler.
Protein kaynaklı ingrediyenlerin absorblayıp yapıda tuttuğu su çeşitli gıdaların yapı oluşturma yeteneğiyle bazı özelliklerini oluşturmaktadır. Bunlar çoğunlukla et ürünlerinde ve hamurda gözlenen özelliklerdir. Su absorbsiyonu (emme,yapışım alma) yolu ile protein su alarak şişer ve böylece karakteristik olan yapı, tekstür, viskozite ve adhezyon gibi gıdanın bazı önemli reolojik özellikleri ortaya çıkar.
Çözünme Özelliği
Proteinlerin bazı önemli işlevsel özellikleri proteinin çözünürlüğünden etkilenmektedir. Bu etkileşimler proseste ( üretim süreci ) uygulanan teknolojik işlemler açısından büyük önem taşır. Çözünürlükten; kalınlaşma, emülsiyon, köpük ve jel yapıcılık gibi özellikler fazla etkilenmektedir. Çözünmeyen proteinlerin gıda endüstrisinde kullanımında çok dikkatli olunmalıdır.
Proteinlerin proses sırasındaki çözünürlük durumlarını etkileyen yapısal interaksiyon doğasından kaynaklanmaktadır. Bunlar sırasıyla hidrofobik ve iyonik yapılardır. Üretimde kullanılan parametreler de bu durumu ayrıca etkilemektedir. Hidrofobik interaksiyonlar (etkileşimine) protein-protein interaksiyonuna (etkilesimine) yol açarak çözünürlüğün azalmasına yol açar. Bunun karşın iyonik interaksiyonlar protein-su etkileşimine neden olur ve çözünürlüğü artırır.
Proteinin çözünürlüğü veya çözünmeme mekanizması doğal özelliğinden kaynaklandığı gibi herhangi bir etmene bağlı olarak da ortaya çıkabilmektedir. Bir proteinin çözünürlüğü: ortamın pH'ına, iyonik kuvvetine, ortam sıcaklığına (°C) ve protein konsantrasyonu ile ortamdaki organik çözücü gibi faktörlerin varlığına da bağlıdır.
Viskozite Özelliği
Bir sıvının viskozitesi akışa karşı gösterdiği dirençle tanımlanır. Ancak tüketicilerin sıvı ya da yan katı gıdalara yönelik tercihi de ürünün viskozitesine bağlıdır.
Proteinlerin viskozite davranışları çeşitli değişkenler arasındaki kompleks interaksiyonlara dayanmaktadır. Bunlar sırasıyla boyut, şekil, protein çözelti interaksiyonu, hidrodinamik hacim ve hidrate konumdaki moleküler esnekliktir. Protein su içinde öncelikle suyu absorblar ( yapısına almak, ,emmek ) daha sonrada sişer. Hidrate molekülün hacmi, hidrodinamik boyut ve hacim daima hidrate olmamış molekül boyutu ve hacminden büyüktür.
Protein sistemlerinin viskozite özellikleri sıvı gıdalarda büyük önem taşır. Örneğin içecekler, hazır çorbalar, soslar ve kremalar yapılarında yer alan proteinlerin gösterdiği dispersiyon özellikleri nedeniyle imalat sırasındaki üretim kriterlerinin optimizasyonunda farklılıkların doğmasma neden olur.
Jelleşme Özelliği
Jel, sıvı ve katı bir ortam arasında oluşan ara bir fazdır. Jelasyon bir çok protein için önem taşıyan işlevsel bir özelliktir. Birçok gıdanın hazırlanmasında jelasyon önemli rol oynar. Denatüre olmuş protein molekülleri düzenli bir protein ağ yapı oluşturmak üzere agrege ( toplanmak )olduklarından jelasyon prosesi gerçekleşmektedir. Protein jelasyonu yalnızca katı-viskoelastik jel oluşumunda değil, aynı zamanda su absorblama gücünün gelişmesi, kalınlaştırma partiküllerin bağlanması, köpük stabilizasyonu gibi proseslerde de kullanılmaktadır.
Ağ yapı oluşmasındaki interaksiyonlar öncelikle hidrojen bağları, hidrofobik ve elektrostatik interaksiyonlardır. Proteinler iki tip jel oluşturur; bunlardan ilki koagülasyona dayalı opak jel, ikincisi ise yarı şeffaf jeldir.
Yapı (Tekstür) Oluşturma Özelliği
Bazı bitkisel ve hayvansal proteinlerden hazırlanan çeşitli preparatlar gıda endüstrisinde tekstürel özellikleri geliştirmek amacıyla kullanılmaktadır. Özellikle soya ve süt proteinleri ısıl koagülasyon işlemine tabi tutulduktan sonra film ya da fiber benzeri karışımlar haline getirilmekte ve yüksek su tutma kapasitesine sahip tekstür ajanları olarak kullanılmaktadır.
Ara Yüzey Özelliği
Doğal ya da işlem görmüş çeşitli gıdalar çoğu kez ya köpük ya da emülsiyon yapıdadır. Bu tip dispers sistemler iki faz arasındaki yüzeyde uygun bir amfilik madde yer alıncaya kadar stabil değildir. Bilindiği gibi proteinler amfoter moleküllerdir ve spontan olarak( kendiliğinden ) hava-su ya da yağ-su-yüzey arasına taşınır. Bu kendiliğinden gelişen ve sıvı kütleden yüzey arasına doğru oluşan protein taşınması, proteinin ara yüzeyindeki serbest enerjinin sıvı kütle fazının enerjisinden daha düşük olduğunu gösterir. Böylece denge kurulduğunda, ara yüzey bölgesindeki protein konsantrasyonu sıvı kütle fazındaki konsantrasyondan daha yüksek olmaktadır.
Hamur Oluşturma Özelliği
Buğday endosperminde bulunan gluten hamur oluşumu sırasında karakteristik bir yapı oluşturur. Un suyla karıştırıldığında gluten proteinleri belli bir diziliş sergiler ve çapraz disülfit bağları meydana gelir. Bu çapraz bağlanma üç boyutlu viskoelastik bir yapının oluşmasına neden olur. Bu ağ yapı nişasta ve diğer komponentleri yapısında hapseder. Ekmek ve diğer fırıncılık ürünlerinin pişirilmesi sırasında son ürünün hacmi ve diğer fiziksel özelliklerinden bu ağ yapı sorumludur.
Emilsifiyan Özelliği
Bazı doğal ve işlem görmüş gıdaların bir kısmı köpük bir kısmı da emülsiyon tipi ürunlerdir. Bu tipteki dispers sistemler, iki faz arasındaki ara yüzeyde uygun bir amfilik madde taşımadıkça stabil değildir. Proteinler amfilik moleküller olup bunlar hava-su veya yağ-su gibi ortamlardaki ara yüzeylerde kendiliklerinden doğal bir şekilde hareket eder. Proteinlerin bu spontan hareketleri proteinin ara yüzeyindeki serbest enerjisinin sıvı kitle fazından daha azalmasına neden olur. Böylece denge sağlandığında ara yüzeydeki protein konsantrasyonu sıvı fazdakinden daha fazla hale gelir. Proteinler ara yüzeyde yüksek bir viskoelastik özellik
Köpürme Özelliği
Gıda üretiminde bazı özel durumlarda köpük yapı oluşturmak istenildiğinde yine proteinlerden yararlanılabilmektedir. Böyle bir yapı kek, şekerleme, krema ürünleri, dondurma, hazır şantiler, mus tipi gıdalar ve ekmek gibi ürünlerde özel yapım oluşumuna yardımcı olur. Bu amaçla çoğu kez gaz olarak hava, sınırlı olarak da karbondioksit (CO2) kullanılır. Bazı köpük gıdalar çok kompleks kolloidal bir yapıya sahiptir. Buna en iyi örnek dondurmadır.
Kopük oluşumunu ve stabilitesini etkileyen faktörlerin başında bunu sağlayacak proteinin yüksek çözünürlük özelliği göstermesi gelmektedir. Bunun dışında ortam pH'sı, tuzun varlığı, sakkaroz ya da diğer şekerlerin bulunması, lipit konsantrasyonu gibi faktörler de bu oluşumu büyük ölçüde etkiler. Bunun yanı sıra proteinin bir olgunlaşma evresinden sonra daha stabil bir köpük oluşturduğu da bildirilmektedir
En yüksek köpürme özelligi gösteren protein; yumurta beyazı proteini, hemoglobinin globin kısmı, jelatin, peynir suyu proteini, kazein miselleri, buğday proteinleri ve soya proteinleridir.
Tat - Koku Bağlama Özelliği
Proteinler genelde kokusuz olmalarına rağmen tat ve koku ajanlarını bağlayarak gıdaların duyusal özelliklerini etkiler. Bu nedenle bazı protein preparatları işlevsel ve besleyici özelliklerinin yanı sıra bazı özel tat-koku ögelerini bağlama fonksiyonuna da sahiptir. Diğer taraftan çeşitli proteinler, özellikle yağlı tohum proteinleri ile peynir suyu proteini konsantratı hoşa gitmeyen tat ve koku taşıdıkları için gıda endüstrisinde kullanılmaları kısıtlıdır. Gıdalarda ransit, acımsı, yakıcı tat koku belirtileri ortamda çeşitli tepkimeler sonucu beliren aldehitler, ketonlar, alkoller, fenoller ve serbest yağ asitlerinin varlığından kaynaklanır. Bu ögeler proteinlere ya da başka komponentlere bağlı olduklarında reaksiyon sonucu yapıdan ayrılır ve ortamda kötü tat ve kokunun ortaya çıkmasına yol açar. Bu istenmeyen tat ve kokuyu buhar veya solvent (çözücü) ekstraksiyonu ile uzaklaştırmak mümkün olmayabilir.
Proteinlerin tat ve koku maddelerini bağlama mekanizması proteinin rutubet içeriğine dayanır.
Proteinlerin bu özellikleri gıda endüstrisi açısından büyük önem taşır. Örneğin bitkisel proteinlerden yapılan et benzeri gıdalarda gerçek et tadı ve kokusunun oluşturulması, et tat ve kokusundan sorumlu ajanların proteine bağlanması yolu ile sağlanmaktadır.
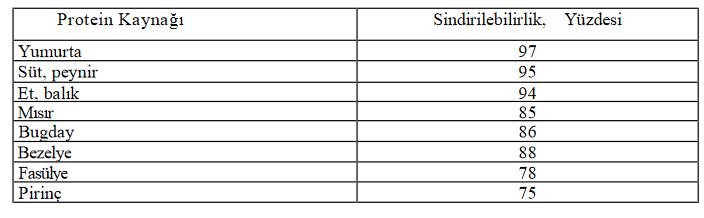
Proteinlerin Kalitesi ve Sindirilebilirliği
Bir proteinin kalitesi, yapısında yer alan elzem aminoasitlerin kompozisyonu ve sindirilebilirliği ile ilgilidir. İnsan beslenmesinde önemli bir yer tutan hububat ve baklagiller çoğu zaman elzem aminoasitlerden herhangi birinin eksikliğini gösterir. Örneğin; pirinç, buğday, arpa ve mısırda lizin miktarı düşükken metiyonin miktarı yüksektir. Bu nedenle bazı aminoasitler açısından eksiklik gösteren gıdalar yüksek içerikli kaynaklar ile birlikte kullanılarak zenginleştirilmektedir. Proteinin sindirilebilirliği, protein içeren gıdanın sindirim sistemine girdikten sonra absorbe edilen azot miktarı ile tanımlanmaktadır. proteinlerin sindirilebilirliği ile ilgili bazı örnekler görülmektedir. Protein ya da protein karışımlarının beslenme açısından kalitesinin ölçütü elzem aminoasitlerini sayıca ve miktarca şekilde içermesi ile ilişkilidir.
Çeşitli gıda proteinlerin sindirilebilirlikleri
Değişik yaş gruplarındaki bireylerin elzem aminoasit gereksinimleri birbirinden farklıdır. Örneğin; 2-5 yaşlar arasındaki bir çocuğun toplam elzem aminoasit gereksinimi 434 mg/g protein iken bu değer 10-12 yaş grubu için 320 mg/g protein ve yetişkinler içinde 111 mg/g protein düzeyindedir. Vücuda yoğun bir biçimde aminoait alınması"aminoasit antogonizmi'ne veya toksisitesine (zehirlenme) yol açar. Bunun yanı sıra yine bir aminoasidin vücuda aşırı düzeyde alınması genellikle diğer bazı aminoasitlerin gereksiniminin artmasna neden olur.
Proteinlerin sindirilebilirliği, gıdanın belli bir porsiyonundan sindirimi izleyen evrede absorblanan azot miktarı olarak tanımlanabilir. Hayvansal kaynaklı proteinler, bitkisel proteinlere göre daha yüksek oranda sindirilir.
Proteinlerin Vücuttaki Görevleri
Proteinler, doğal organik bileşikler arasında dağılım, miktar ve fizyolojik önem bakımından başta gelir. Proteinlerin canlılardaki önemini ortaya koyan bazı özellikler aşağıda özetlenmiştir ;
- Proteinler vücudun en küçük birimi olan hücrelerin yapıtaşıdır.
- Vücut dokularının oluşumunda ve onarımında kullanılır.
- Enzimlerin tümü, hormonların birçoğu ve virüsler protein yapısındadır. Proteinlerin kendi sentez olayları bile protein yapısında olan enzimler sayesinde gerçekleşir.
- Proteinler vücuttaki organların ve yumuşak dokuların yapı unsurudur.
- Proteinler vücudun elzem aminoasitlere olan gereksinimini karşılar.
- Proteinler vücudun enerji kaynağı değildir. Ancak proteinler vücuda fazla miktarda alındığında ya da vücutta yeterli enerji kaynağı olmadığında enerji kaynağı olarak kullanılır.
- Çoğu kez proteinler, gıdaların duyusal özelliklerini ve besleyici değerini belirleyen önemli faktörlerdir.
- Organizmada taşıma ve depolama görevi üstlenir. Örneğin; hemoglobin alyuvarlarda, miyoglobin ise kasta oksijen taşırken, demir kan metabolizmasında transferin tarafından taşınır, karaciğerde ise ferritin ile kompleks oluşturarak depo edilir.
- Proteinler vücuda mekanik destek sağlamada da görev üstlenir. Vücuda destek sağlayan deri ve kemiğin gerilme kuvveti, kolayca fiber oluşturan ve uzun bir protein olan kollagenin varlığı nedeniyledir.
- Sinir impulslarının (dürtülerinin) ortaya çıkması ve iletimi proteinlerle sağlanmaktadır.
- Canlıda başkalaşım ve büyümenin denetimi proteinlerle sağlanır. Bilindiği gibi bir organizmanın tüm hücrelerindeki genetik bilgi aynıdır. Ancak, canlıda farklı doku ve organların bulunması ve çok değişik işlevlerin ortaya çıkması, hücrelerde aynı olan genetik bilginin bazı bölümlerinin sessizleştirilmesiyle (baskılanmasıyla) olasıdır. Büyük organizmalarda ve bakterilerde baskılayıcı (represör) proteinler hücredeki DNAnın özgül bölümlerini sessizleştiren önemli elemanlarıdır.
- Su ve elektrolit dengesinin korunmasında doğrudan ya da dolaylı olarak görevleri vardır.
- Vücudun hastalıklara karşı dayanıklılığında ve hastalık etkenlerine karşı korunmada kullanılır.
- Büyüme ve erginlik dönemlerinde yeni dokuların yapılmasında etkindir.
- Kanın pıhtılaşmasında rol oynar.
- Vücuttaki asit-baz dengesini korumak için tampon vazifesi görür.
- Kasların kontraksiyonunda görev alır.
- Hücrelerle hücreler arası sıvılar arasında besin unsurlarının değişimine yardım ederek ödemlere sebebiyet veren sıvıların anormal bir şekilde toplanmasına engel olur.
Yiyecek Hazırlama ve Pişirmede Proteinlerin Fonksiyonları
Etin proteinleri çiğ iken kolloid sol durumundadır. Isıtıldığı zaman protein denatüre olur ve katılaşır. Sindirim kolaylaşır.
Yumurta proteinleri yemekler içerisinde katılaşmayı ve kabartmayı sağlayıcı görev yapar. Yumurta akı 65 0C de, sarısı da 70 0Cde katılaşır ısı derecesi arttıkça katılaşma hızı da artar. Bu nedenle sütlü tatlılarda ve çorbalarda katılaştırıcı olarak kullanılır. Yumurta çırpıldığı zaman yumurta proteinleri denatüre olur. Örneğin Çırpılan yumurtanın içerisine hava kabarcıkları girer ve kullanıldığı besinin hacmini artırır ( kekin kabarması gibi ).
Sütün katılaşma etkenlerinden biri rennin enziminin aktivitesi, diğeri ise sütün pH sının kazeinin pHsına düşürülmesidir.
Bazı Yiyeceklerde Protein Kaybına Neden Olan Pişirme İşlemleri
Monosakkaritlerin -OH grupları, aminoasitlerin NH2 grupları ile yer değiştirmesiyle amino şeker oluşur. Şekerin aminler ile bu reaksiyonuna maillard reaksiyonu denir ve besin maddelerinin biyolojik değer kaybına neden olur. Çünkü oluşan amino şeker, sindirim enzimleri tarafından ya hiç ya da çok yavaş parçalanır. Örneğin, proteinlerdeki temel aminoasitlerden lizin kendisinden faydalanılamaz şekle girer.
Aşağıda bazı yiyeceklerde protein kaybına neden olan pişirme işlemleri özetlenmiştir;
- Sütlü tatlıların küçük kaseler halinde yüksek sıcaklıktaki fırında pişirilmesi,
- Nohut, fıstık, fındık vb. gibi yiyeceklerin yüksek sıcaklıktaki fırında veya saç üzerinde kavrularak çerez durumuna getirilmesi
- Yufka ve lavaş vb yiyeceklerin sıcak saç üzerinde ince olarak pişirilmesi
- Ekmeğin ince dilimler halinde fırında ve ızgarada kızartılması.
- Çorba ve çocuk maması yaparken unun kuru ısıda önceden sararıncaya kadar kavrulması
- Pirincin pilav ve dolma yaparken önceden kuru ısıda sararıncaya kadar kavrulmasıdır
Gıda Teknolojisi