Moleküler Geometri
Moleküler geometri, moleküldeki atomların üç boyutlu düzenlenmesidir. Bir molekülün geometrisi, onun fiziksel ve kimyasal özelliklerini (erime noktası, kaynama noktası, yoğunluk ve gireceği reaksiyonların türü vb.) etkiler.
Genelde bağ uzunlukları ve bağ açıları deneylerle belirlenmelidir. Bununla beraber Lewis yapısındaki merkez atomu çevresindeki elektronların sayısı bilinirse, molekül veya iyonun geometrisi hakkında yaklaşık bir tahminde bulunulabilir. Bu yaklaşımın temeli değerlik tabakasındaki elektronların birbirini itmesidir.
Bir moleküle ilişkin moleküler geometrinin, elektronların birbirini itmesini en aza indirdiği varsayılır. Bu yaklaşıma "değerlik tabakası elektron çifti itme modeli (VSEPR modeli)" denir. Bu model yardımıyla, moleküllerin (ve iyonların) geometrisini sistematik bir şekilde tahmin edebiliriz. Bu amaçla molekülleri merkez atomunda ortaklanmamış elektron çiftleri olan ve olmayanlar olarak ikiye ayırabiliriz.
Tablo1: Bir Molekülde Merkez atom (A) 'nın Etrafındaki Elektron Çiftlerinin Düzenlenmesi ve Merkez Atomda Ortaklanmamış Elektron Çifti Olmayan Bazı Asit Molekül ve iyonların Geometrileri 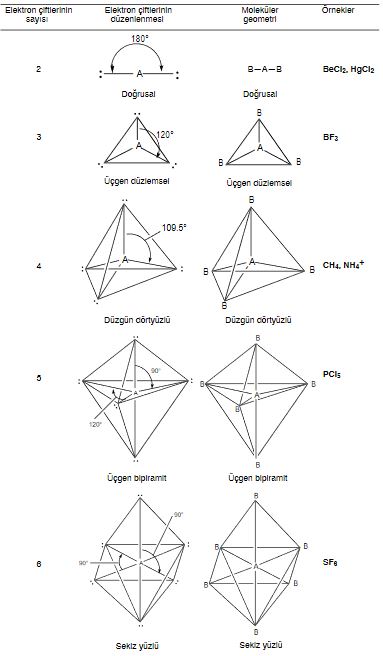
Merkez Atomu Üzerinde Ortaklanmamış Elektron Çiftleri İçermeyen Moleküller
Bu durumun kolay anlaşılması için, sadece iki elementin atomlarını içeren molekülleri ele alacağız.
Örneğin: A'nın merkez atom olduğu, A ve B atomlarından oluşan moleküller.
Tablo1 merkez atomu A'nın etrafındaki elektron çiftlerinin beş olası düzenlenmesini göstermektedir. Bu tabloyu kullanarak bazı moleküllerin örneğin berilyum klorür'ün
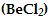
geometrisini inceleyelim.
Gaz halindeki berilyum klorürün Lewis yapısı
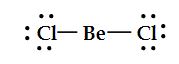
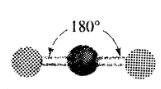
şeklinde gösterilir. Bağ yapan elektron çiftleri (birbirlerini ittikleri için) berilyum atomunun zıt taraflarında yer alırlar. Böylece ClBeCl açısı 180° olarak tahmin edilir ve molekül doğrusaldır (Tablo1). Bu şekil deneyle de doğrulanmıştır.
 Bor Triflorür
Bor Triflorür 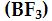
Bor triflorür üç kovalent bağ (veya üç bağ yapan elektron çifti) içerir. En kararlı düzenlemede, merkez bor atomu etrafındaki flor atomları, bir eşkenar üçgenin köşelerinde yer alır ve
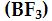
'ün geometrisi üçgen düzlemseldir. (Tablo1)
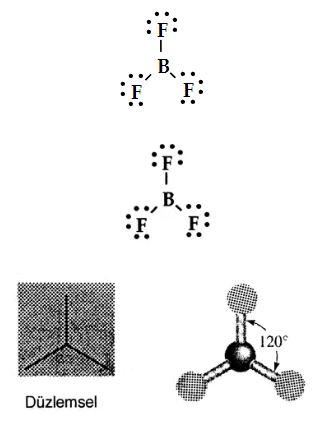
Böylece, üç FB F açısı 120° 'dir ve
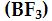
molekülündeki dört atomun hepsi aynı düzlemdedir.
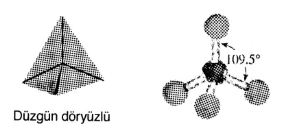
Metan 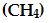
Metan'ın Lewis yapısı

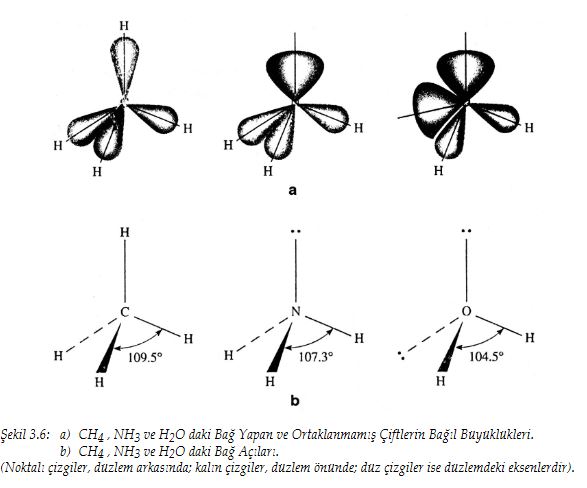
şeklinde gösterilir. Dört bağ yapan elektron çifti olduğu için, metan'ın geometrisi düzgün dörtyüzlüdür (Tablo1). Metan'da karbon atomu merkezde olmak üzere dört hidrojen atomu düzgün dörtyüzlünün köşelerinde yer almaktadır. Bundan dolayı molekülün tüm bağ açıları 109,5° 'dir. Bu şekil deneyle de doğrulanmıştır.
Merkez Atom Üzerinde Ortaklanmamış Elektron Çiftleri İçeren Moleküller
Merkez atomunda hem bağ yapan elektronları, hem de ortaklanmamış elektronları bulunan moleküllerin geometrilerini belirlemek, çok daha karmaşıktır. VSEPR modeli, ortaklanmamış çiftlerin, bağ yapan çiftlere göre daha kuvvetli itici olduğunu varsayar. Amonyak ve su, bu tür moleküllere verilebilecek iyi birer örnektir.
Amonyak 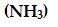
Amonyak molekülü üç tane bağ yapan elektron çifti ve bir tane de ortaklanmamış elektron çifti içerir.
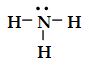
Tablo1 'de görüldüğü gibi dört elektron çiftinin düzenlenmesi düzgün dörtyüzlüdür. Fakat NH3 'da bir elektron çifti ortaklanmamış olduğu için, NH3 'ın geometrisi üçgen piramittir. Çünkü elektron ortaklanmamış çifti, bağ yapan elektron çiftlerini kuvvetli bir şekilde iter. Böylece üç NH bağı birbirlerine yaklaşırlar.
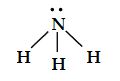
Böylece amonyaktaki HNH açısı, ideal dörtyüzlü açısı 109,5° den daha küçüktür.
 Su
Su 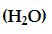
Su molekülü iki tane bağ yapan elektron çifti, iki tane de ortaklanmamış elektron çifti içerir.
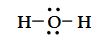
Su molekülündeki dört elektron çiftinin düzenlenmesi, amonyaktaki gibi dörtyüzlüdür. Bununla beraber suda merkez oksijen atomunun iki ortaklanmamış elektron çifti vardır. Bu ortaklanmamış çiftler birbirlerinden olabildiğince uzakta olmaya yatkındırlar. Sonuç olarak iki OH bağ elektron çiftlerini birbirlerine doğru iterler ve biz NH3 molekülüne göre bağ açısında daha büyük bir sapma bekleriz. Aşağada görüldüğü gibi HOH açısı 104,5° dir. Suyun geometrisi "V" şeklinde olup açısaldır.
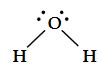
VSEPR gösteriminde; A merkez atomu, X merkez atomuna bağlı atom (ya da atom grupları), E ortaklanmamış elektron çiftidir. Örneğin, AX2E2 sembolü merkez atoma (A) bağlı iki atom ya da grubu (X) ve ortaklanmamış iki elektron çiftini (E) göstermektedir. Su (H2 O), AX2 E2 tipinde moleküllere bir örnektir.