Çözeltiler
Çözeltilerde bir veya birden fazla türde madde diğer madde türünün içinde homojen olarak dağılmıştır.Bir bardak çaya attığımız şekere ne olur? Küçük bir şişede hapsolmuş parfüm sıkıldığında nasıl olur da kısa sürede odanın kokusunu değiştirir? Cevaplarını vermek için biraz düşündüğümüzde çözeltilerin yaşantımızın büyük bir kısmında var olduğunu farkederiz. Şimdi bu kavramı bir kimyacı gözüyle bakarak bilimsel hesaplamalarla doğru olarak açıklayabileceğiz.
Çözünme
Bir maddenin bir başka madde içerisinde kimyasal özelliklerini kaybetmeden serbest moleküller veya iyonlar halinde homojen olarak dağılmasına çözünme, oluşan karışıma ise çözelti denir.
Çözelti bir karışım olduğundan, en az iki bileşeni vardır. Bileşenlerden miktarı çok olan dağılma ortamına çözücü miktarı az olan ve dağılan maddeye de çözünen denir.
Örneğin, bakır sülfat çözeltisinde; katı bakır sülfatın suda dağılması olayı çözünme, bakır sülfat çözünen, su ise çözücüdür.
Çözücü ve çözünenin birbiri içinde karışması ile gerçekleşen çözünme olayı, moleküller arasındaki çekim kuvveti ile çözünenin molekülleri arasındaki çekim kuvvetine dayanır.
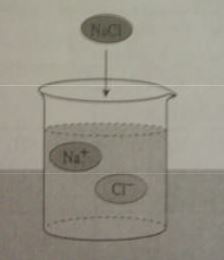
Bir çözücünün bir maddeyi çözebilmesi için; çözücü ve çözünenin kendi molekülleri arasındaki çekim kuvvetlerinin, çözücü ve çözünen molekülleri arasındaki çekim kuvvetinden daha küçük olması gerekir. Örneğin, katı haldeki yemek tuzu (NaCl) kristalinde güçlü çekim kuvvetleri vardır. Suya atılan NaCl kristalindeki sodyum iyonları ( Na+ ) su molekülündeki negatif yüklü oksijen tarafından kuşatılır. Negatif yüklü klorür iyonları ( Cl ) da su molekülündeki pozitif yüklü hidrojen tarafından kuşatılır. Oluşan elektriksel kuvvetler, Na+ ve Cl iyonları arasındaki çekim kuvvetinden daha büyük olduğu için iyonlar kristalden ayrılarak su içinde homojen olarak dağılır.
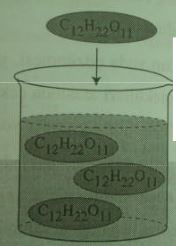
Şeker gibi molekül yapılı bileşikler su içinde çözündükleri zaman moleküller halinde dağılır.
Çözelti oluşurken saf çözünen ve saf çözücü moleküllerinin kendi aralarındaki çekim kuvvetlerinin yerini, çözünen - çözücü çekim kuvvetleri alır. Örneğin, çözünen maddedeki bağlar hidrojen bağları ise hidrojen bağları olan bir çözücüde çözünmesi daha muhtemeldir. Çözünecek maddenin molekülleri arasında başlıca çekim kuvvetleri london kuvvetleri ise en iyi çözücü yine benzer kuvvetlerce bir arada tutulan çözücülerdir. Örneğin karbonsülfür, katı kükürt için sudan daha iyi bir çözücüdür.
Sonuç olarak polar çözücüler polar maddeleri, apolar çözücüler apolar maddeleri daha iyi ve kolay çözer ( benzer, benzeri çözer).
Yine iyonik bileşikler polar çözücülerde çok iyi çözünür. Çünkü polar çözücü molekülleri, bileşikteki zıt yüklü iyonları iyon - dipol çekim kuvvetleriyle çekerek iyonun etrafını çözücü molekülleri ile sarar. Bu iyonlarda çözücüye geçerek çözünür. Dolayısıyla çözelti oluşturur( Şekil 1.4).
Çözünme olayı çözücü ve çözünenin cinsine bağlıdır diyebiliriz. Aşağıdaki resimlerde çözücü, çözünene uygundur ve tam çözünme olmuştur
Aşağıdaki resimde ise çözücü çözünene uygun değildir ve tam bir çözünme olmamıştır.
Çözelti Türleri
Bir çözelti en az iki bileşenden meydana gelir. Çözeltiler fiziksel hallerine göre, elektrik akımını iletmelerine göre ve bileşenlerin miktarlarına göre değişik açılardan sınıflandırılır.
Çözeltiler yukarıda belirtilen gruplandırmalar açısından değerlendirildiğinde her bir grubun kendi içinde sınıflara ayrıldığı görülür. Şekil 1.5de genel olarak gösterilen çözelti türlerinden fiziksel hale göre yapılan sınıflandırmada, bileşenlerin fiziksel halleri göz önünde bulundurulduğunda çeşitli çözeltiler hazırlanabilir;
Tablo 1.1 de çözen ve çözünenin fiziksel durumuna göre meydana gelen çözeltiler görülmektedir. Çözücü katı ise, çözünenin sıvı, katı, gaz oluşuna göre 3 türlü, çözücü sıvı ise, çözünenin sıvı, katı, gaz oluşuna göre 3 türlü çözelti hazırlamak mümkündür. Çözücü gaz olduğunda ise, gazlar içinde gazlar kolay çözünür. Fakat gazlar içinde katı ve sıvılar daha zor çözündüğünden homojen bir çözelti oluşturması güçleşir. Çözen madde çözeltinin fiziksel halini belirler. Örneğin, çözücüsü katı olan çözeltinin fiziksel hali de katıdır.
Katı çözeltiler iki ya da daha çok metalin eritilerek oluşturdukları homojen katı karışımlardır. Bunlara alaşım denir. Alaşımlarda bir metalin atomları diğer metalin kristal yapısı içine girerek homojen bir karışım oluşturur. Örneğin paslanmaz çelik ( 76 Fe, 16 Cr, 8 Ni), Pirinç ( 60 Cu, 40 Zn ), Bronz ( 80 Cu, 15 Sn, 5 Zn ) birer alaşımdır.
Gaz çözeltiler ise iki veya daha çok gazın aynı kap içine konulduğunda homojen olarak karışmasıyla oluşur. Örneğin hava bir gaz çözeltisidir.
Kimyasal reaksiyonların çoğu sıvı çözeltilerde yürüdüğünden, kimyacılar için en önemli olanı sıvı çözeltilerdir. Sıvı çözeltilerin günlük yaşamda da önemi ve tüketimi büyüktür. Sıvı çözeltiler; çözücüsü sıvı olan, çözüneni ise katı, sıvı ya da gaz olan çözeltilerdir. Sıvı çözücü içinde, katı çözünürken çözünme katı maddenin dış yüzeyinde başlar. Katı maddenin yüzeyi ne kadar büyükse ve çözücüyle temas ederse, çözünme de o kadar kolay ve hızlı olur. Ayrıca katının toz haline getirilmesi ve çözücü içerisinde karıştırılması, çözünmeyi kolaylaştırır ve hızlandırır.
Maddelerin çözünmeleri dışarıdan ısı alarak ya da dışarıya ısı vererek gerçekleşir. Katının sıvı içerisinde çözünmesi esnasında sıcaklık artışı çözünmeyi artırır. Gazlarda ise bu durum tam tersidir ve gazların sıvıdaki çözünürlüğü sıcaklık artışı ile azalır.Bir sıvı içinde katı madde çözerken dışarıdan basınç uygulamak çözünmeye etki etmez.
Sıvı içinde başka bir sıvının çözünmesiyle oluşan çözeltiler, sıvı-sıvı çözeltileri olarak nitelendirilir. Sıvıların bazıları birbiriyle her oranda karışabildikleri gibi, bazıları sınırlı karışabilir. Bazıları ise hiç karışmaz. Bunun nedeni karışan bu iki sıvının polar yapılarına dayanır. Örneğin polar olan etanol su molekülleri tarafından çekilerek suda çözünür (kolonya gibi), fakat polar olmayan karbon tetra klorür(CCI4) suda çözünmez. Çünkü su molekülleri polar yapıları nedeniyle birbirini bir ağ oluştururcasına çeker.Karbon tetra klorür ise suyun bu yapısını bozamaz ve dolayısıyla çözünme gerçekleşmez.
Sıvı içinde gaz maddenin çözünmesi ile sıvı-gaz çözeltileri oluşur. Örneğin gazoz, içerisinde karbondioksit gazı içerir.
Gazların sıvılardaki çözünürlükleri de diğer çözeltide olduğu gibi maddelerin cinsine ve sıcaklığına bağlıdır. Ayrıca basıncında çözünmeyi arttırıcı etkisi vardır. Kutuplu yapıdaki hidrojen klorür ve amonyak gibi gaz bileşikler, yine kutuplu yapıdaki su molekülleri tarafından çekilerek yeterince çözünür. Fakat Hidrojen (H2), Azot (N2), Oksijen (O2) gibi kutupsuz yapıdaki gazların sudaki çözünmeleri oldukça zayıftır.
Çözücüsü su olan çözeltilere kısaca sulu çözeltiler de denir. Suda çözünen maddeler fiziksel hallerine ve kimyasal yapılarına bağlı olarak farklı davranışlar gösterir. Genel olarak atomları arasında kovalent bağ bulunan yani molekül yapılı bileşikler suda çözündüğünde moleküler yapılarını korur ve molekül halde suda dağılır.
şeker, su içinde moleküller halinde bulunur.
Buna karşılık NaCl (yemek tuzu) gibi iyon yapılı bileşikler suda çözündüklerinde iyonlarına ayrılır.
NaCl, sulu çözeltide Na+ ve Cl iyonları halinde bulunur.
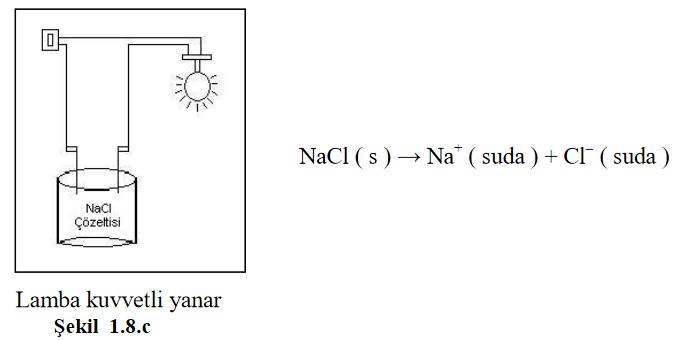
Asitler ve bazlarda, tuzlar gibi suda çözündüklerinde iyonlar oluştururlar. Çözeltide oluşan bu iyonlar elektrik akımını iletir. Sulu çözeltisi elektrik akımını ileten maddelere elektrolit madde, çözeltisine ise elektrolit çözelti denir. Su içinde iyonlaşma yüzdesi yüksek olan maddeler kuvvetli elektrolittir ve bu maddelerin çözeltileri elektrik akımını iyi iletir. İyonlaşma yüzdesi düşük olanlar ise zayıf elektrolit olup, bunların sulu çözeltileri elektrik akımını az iletir.
Na+, K+, H+, NH4+, NO3_ gibi iyonların bileşikleri kuvvetli elektrolittir. Ag+, Cu+, Pb+2 iyonların klorürleri Be+2.Sr+2,Pb+2 nin sülfatları zayıf elektrolittir.
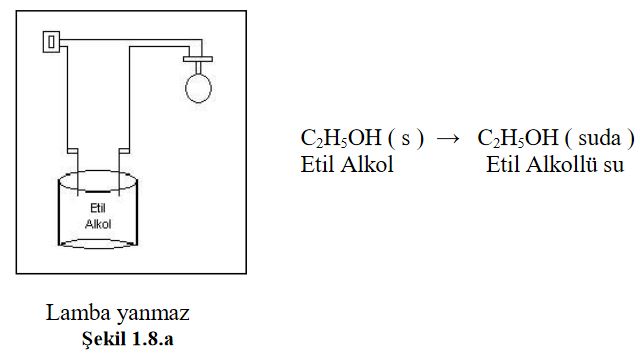
Alkol, şeker gibi moleküler halde çözünen maddelerde iyonlaşma olmadığından bu maddeler elektrik akımını iletmez.. Şekil 1.8. a, b ve.cyi inceleyiniz.
Etil alkol gibi moleküller halinde çözünmüş bu tür maddelere elektrolit olmayan madde, çözeltisine ise elektrolit olmayan çözelti denir.

Elektrolitlerin vücudumuzda çok önemli düzenleyici görevleri vardır. Bir çözeltinin özelliği çözünme miktarına göre değişir. Sıvı çözücüde çözünen maddenin miktarı, çözeltinin bir başka açıdan türünü belirler ( Doymamış, Doymuş, Aşırı Doymuş çözelti ). Çözeltiyi oluşturan bileşenlerden birinin ( çözücü veya çözünen ) miktarının sabit tutulup, diğerinin azaltılması veya arttırılmasıyla da ( seyreltik çözelti, derişik çözelti ) çözelti türleri sınıflandırılabilir. Bu sınıflandırma türleri hakkında geniş bilgiyi çözelti 2 ve çözelti 3 modüllerinde bulacaksınız.
Çözelti Derişimleri
Bir çözeltinin özelliği çözünen maddenin miktarına göre değiştiği için, çözeltide ne kadar çözünenin bulunduğunu ifade etmek önemlidir. Derişim, diğer adıyla konsantrasyon çözeltide ne kadar çözünenin bulunduğunu ifade eden terimdir. Bir çözeltinin birim hacminde çözünen madde miktarına derişim denir. C ile gösterilir.
Derişim, çözücü ve çözünenin miktarlarına bağlı olarak yüzde derişim, mol kesri, molarite, normalite, molalite, ppt ( binde bir ), ppm ( milyonda bir ), ppb (milyarda bir ) olarak farklı büyüklüklerde ifade edilir. Bir başka deyişle çözelti hazırlanırken, çözündürülecek maddeden ne kadar alınması gerektiğini ve aynı zamanda kullanılan çözeltideki konsantrasyonun, yani çözündürülmüş madde miktarının ne kadar olduğunu göstermek için kullanılan ifadelerdir.
Yüzde Çözeltiler
Yüzde kelimesi birkaç anlamı ifade etmektedir. Örneğin % 10 luk şeker çözeltisi denildiği zaman şu anlamlar çıkmaktadır.
10 g şeker çözündürülerek 100 mlye tamamlanmıştır
10 g şeker, 100 ml saf suda çözündürülmüştür.
10 g şeker, 100 g saf suda çözündürülmüştür.
10 g şeker, 90 g saf suda çözündürülmüş her ikisinin toplam ağırlığı 100 gramdır.
Bu nedenle yüzde ifadesi kullanılırken mutlaka yapılan işin gerçek anlamı belirtilmelidir.
Genel bir tanımlamayla;
Çözeltinin 100 biriminde çözünen madde miktarına yüzde çözelti denir. Ve % işaretiyle ile gösterilir. Kütlece yüzde, hacimce yüzde ve hacim-kütlece yüzde olmak üzere üç şekilde ifade edilebilir.
Kütlece Yüzde Çözeltiler
100 g çözeltide kaç g çözünen maddenin olduğunu gösterir. Birim olarak gram, kilogram, miligram, ton vb. olabilir. Örneğin kütlece % 20lik sodyum klorür çözeltisi demek 100 g sodyum klorür çözeltisinin içinde 20 g katı sodyum klorür var demektir. Ya da 100 ton sodyum klorür çözeltisinin içinde 20 ton katı sodyum klorür var demektir. Burada çözünenin ve çözeltinin miktarı ağırlık birimiyle ifade edilmelidir.
Hacimce Yüzde Çözeltiler
100 ml çözeltide kaç ml çözünen maddenin olduğunu gösterir. Birim olarak mililitre, litre, metreküp vb. olabilir. Örneğin hacimce % 20 lik alkol çözeltisi demek 100 ml alkol çözeltisinin içinde 20 ml saf alkol var demektir. Ya da 100 lt alkol çözeltisinin içinde 20 lt saf alkol var demektir. Burada çözünenin ve çözeltinin miktarları hacim birimiyle ifade edilmelidir.
Hacimce - Kütlece Yüzde Çözeltiler
100 ml çözeltide kaç g maddenin çözündüğünü gösterir. Birim olarak mililitre, litre, metreküp vb. olabilir. Örneğin hacim - kütlece % 20lik sodyum klorür çözeltisi demek 100 ml sodyum klorür çözeltisinin içinde 20 g sodyum klorür var demektir. Burada çözeltinin şeklinde ifade edilir.
megep