Bağ polaritesi
İki tür kovalent bağ vardır: polar ve polar olmayan (veya saf). Saf
kovalent bağlar (ki genellikle çözünür değildirler, elektrik iletkenlikleri yoktur ve bireysel molekül formundadırlar) ve iyonik bağlar (çözünürdürler, ergimiş ve çözünmüş haldeyken elektrik iletirler, ve genellikle kristal formundadırlar) spektrumun iki ucunda yer alırlar ve farklı özelliklere sahiptirler. Polar kovalent bağlar ise ortada yer alır ve her ikisinin de özelliklerini gösterirler.
Kovalent Bağ
Ametal ametal atomları arasında elektron ortak kullanılması sonucu oluşan kimyasal bağa kovalent bağ denir.
Kovalent bağ (iyonik ve metalik bağın tersine) yönlüdür; bağ açılarının etkileşimin gücü üzerinde etkisi büyüktür. Bu etkinin kaynağı, kovalent bağların, atomik yörüngelerin üst üste binmesiyle oluşmasından ileri gelir. Atomik yörüngeler (p, d, ve f orbitalleri) hepsi yönlü karakterde olup, bağlanma esnasında önemli ölçüde yöne bağlı etkileşime neden olurlar.
Kovalent bağ, genellikle benzer elektronegatifliğe sahip atomlar arasında gerçekleşir. Bu nedenle ametaller, daha kolaylıkla kovalent bağı tercih eder ve metaller de kolayca yerlerinden oynatılabilen elektronların daha serbestçe dolaşabildiği metalik bağ yaparlar. Ametallerde bir elektronun serbest kalması daha zordur, dolayısıyla benzer elektronegatifliğe sahip bir madde ile birleşme söz konusu olduğunda o elektronun paylaşılması tek seçenek haline gelir.
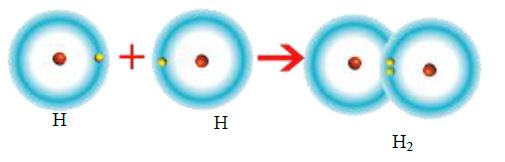
Tek elektron ortak kullanılması sonucu oluşan bağa tekli kovalent bağ denir. Hidrojen atomları arasında oluşan bağ tekli kovalent bağdır.
(H-H)
İki elektron ortaklaşması sonucu oluşan kovalent bağa ikili kovalent bağ denir. Oksijen atomları arasında oluşan bağ ikili
kovalent bağdır.
(O=O)
DEVAMI Kovalent Bağ