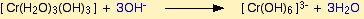Geçiş Elementleri (Geçiş Metalleri)
MsXLabs.org & Vikipedi, özgür ansiklopedi
Geçiş metalleri veya bazı kimyacıların tabiri ile ile Ağır Metaller, sertlikleri, yüksek yoğunlukları, iyi ısı iletkenlikleri ve yüksek ergime-kaynama sıcaklıklarıyla tanınırlar. Özellikle sertlikleri nedeniyle, saf halde ya da alaşım halinde yapı malzemesi olarak kullanılırlar.
Geçiş elementlerinin hepsi, elektron dizilimlerinde, en dışta her zaman d-orbitalinde elektron taşırlar. Tepkimelere giren elektronlar da, d-orbitalindeki elektronlardır. Geçiş metalleri sıklıkla birden fazla yükseltgenme basamağına sahiptir. Çoğu, asit çözeltilerinde hidrojenle yer değiştirecek kadar elektropozitiftir.
İyonları renkli olduğu için, analizlerde kolay ayırt edilirler.
Geçiş Elementleri (Geçiş Metalleri)
01. Vanadyum V
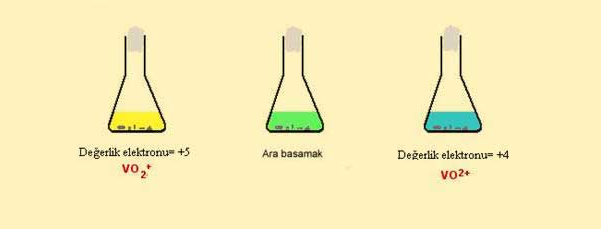
Periyodik tablonun 5B grubu elementi olan vanadyum, redoks tepkimesinden dolayi bir çok proseste katalizör olarak kullanilmaktadir.Vanadyumun +5, +4, +3, +2 oksidasyon basamagina sahiptir. Vanayumun +5 oksidasyon basamagi amonyum metavanadat (NH4VO3) bilesiginde mevcuttur.Vanadyum V'in çinko ve asit yardimi ile Vanadyum (II)'ye indirgenir. Bu reaksiyon iki basamakta gerçeklesir. Amonyum metavanadat sodyum hidroksitte çözüldükten sonra ortama çinko eklenerek ve derisik asit kullanarak ortam asidik hale getirilir. Bu sartlarda ortamdaki vanadyum iyonu, dioksovanadyum V iyonuna dönüsür (VO2+) . Eger bu reaksiyon agzi yün pamuk ile kapatilmis bir erlende gerçeklestirilirse, bu yün pamuk açiga çikan H iyonunun ortamda uzaklasmasina izin verirken ayni zamanda içeriye hava girisini engelliyecektir.
MsXLabs.org & Vikipedi, özgür ansiklopedi
Sponsorlu Bağlantılar
Geçiş metalleri veya bazı kimyacıların tabiri ile ile Ağır Metaller, sertlikleri, yüksek yoğunlukları, iyi ısı iletkenlikleri ve yüksek ergime-kaynama sıcaklıklarıyla tanınırlar. Özellikle sertlikleri nedeniyle, saf halde ya da alaşım halinde yapı malzemesi olarak kullanılırlar.
Geçiş elementlerinin hepsi, elektron dizilimlerinde, en dışta her zaman d-orbitalinde elektron taşırlar. Tepkimelere giren elektronlar da, d-orbitalindeki elektronlardır. Geçiş metalleri sıklıkla birden fazla yükseltgenme basamağına sahiptir. Çoğu, asit çözeltilerinde hidrojenle yer değiştirecek kadar elektropozitiftir.
İyonları renkli olduğu için, analizlerde kolay ayırt edilirler.
Geçiş Elementleri (Geçiş Metalleri)
- 01. Vanadyum V
- 01.01. Vanadyum V oksit
- 02. Krom (Cr)
- 02.01 Krom (III) iyon içeren bilesiklerinin reaksiyonları
- 02.02. Cr (III)'ün Cr (VI)'ya yükseltgenmesi
- 02.03. Kromat (VI) -Dikromat (VI) Dengesi
- 02.04. Dikromat iyonunun indirgenmesi
- 03. Mangan (Mn)
- 3.1 Mn (III) Iyonunun Sulu Çözeltilerinin Reaksiyonları
- 3.2. Potasyum Permanganat (VII) Kimyası
- 04. Demir
- 04.01. Demir iyonunun sulu çözeltilerinin reaksiyonları
01. Vanadyum V
Periyodik tablonun 5B grubu elementi olan vanadyum, redoks tepkimesinden dolayi bir çok proseste katalizör olarak kullanilmaktadir.Vanadyumun +5, +4, +3, +2 oksidasyon basamagina sahiptir. Vanayumun +5 oksidasyon basamagi amonyum metavanadat (NH4VO3) bilesiginde mevcuttur.Vanadyum V'in çinko ve asit yardimi ile Vanadyum (II)'ye indirgenir. Bu reaksiyon iki basamakta gerçeklesir. Amonyum metavanadat sodyum hidroksitte çözüldükten sonra ortama çinko eklenerek ve derisik asit kullanarak ortam asidik hale getirilir. Bu sartlarda ortamdaki vanadyum iyonu, dioksovanadyum V iyonuna dönüsür (VO2+) . Eger bu reaksiyon agzi yün pamuk ile kapatilmis bir erlende gerçeklestirilirse, bu yün pamuk açiga çikan H iyonunun ortamda uzaklasmasina izin verirken ayni zamanda içeriye hava girisini engelliyecektir.
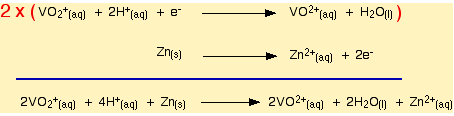
Yukaridaki tepkimenin redoks tepkimesi asagidaki gibidir.
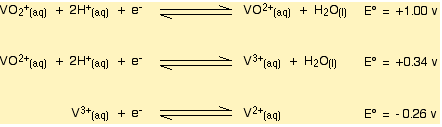
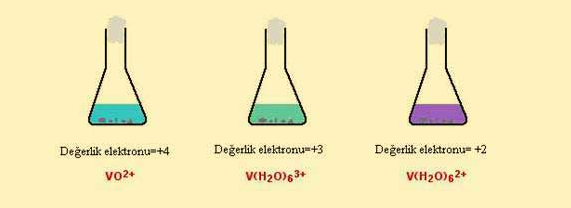
Daha sonra vanadyum +4 ikinci bir basamakla vanadyum +2'ye indirgenir.
01.01. Vanadyum V oksit
Sülfürik asit eldesi prosesinde, sülfür dioksidin sülfür triokside dönüstürülmesi gerekmektedir. Bu ara basamakta sülfür dioksit oksijen ile vanadyum V oksit katalizörü esliginde reaksiyona girerek sülfür trioksit elde edilir.
Yukaridaki örnek geçis metallerinin ve onlarin bilesiklerinin iyi bir katalizör oldugunu açiklayabilmek için çok iyi bir örnektir. Bu bilesiklerin reaksiyona giren maddelerin oksidasyon sayisini degistirme özelligine sahiptirler. Söyle ki sülfür dioksit vanadyum V oksit tarafindan sülfür triokside yükseltgenirken ayni zamanda kendiside vanadyum (IV) oksit formuna indirgenir.
Daha sonrada ortamdaki oksijen ile tekrar vanadyum V oksit formuna yükseltgenir. Bir katalizör reaksiyon süresince geçici olarak degisiklige ugruyabilir. Fakat reaksiyonun sonunda basladigi yapida olmak zorundadir.
02. Krom (Cr)
Geçis elementlerinden krom 6B grubu elementidir. Krom bilesiklerinde Cr (III) veya Cr (VI) halinde bulunur.
02.01 Krom (III) iyon içeren bilesiklerinin reaksiyonları
Krom (III) iyonu en basit hali ile hekzaaaquakrom(III) bilesiginde bulunur [Cr(H2O)6]3+. Hekzaaaquakrom (III) kompleksinin su ile reaksiyonunda, hekzaaaquakrom(III) asit oldugu için donör görevini üstlenip bir protonunu baz olarak davranan su molekülüne verir.
Hekzaaaquakrom(III) bilesiginin renk degistirmesini çesitli reaksiyonlarla açiklanabilir.
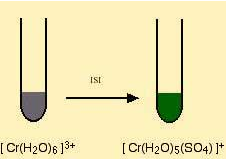
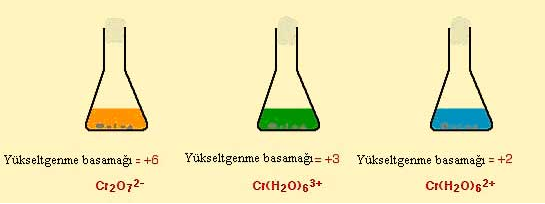
Bunlardan ilki bu kompleks çözeltinin ligand degistirmesi ile baslangiç renginde degisiklik gözlenir. Hekzaaaquakrom(III) bilesigindeki bir su molekülünün ortamdaki eksi yüklü sülfat (SO4) molekülü ile renk degistirmesi sonucunda renk degisimi gözlenir.
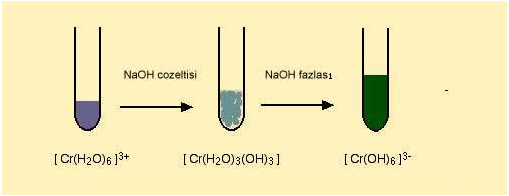
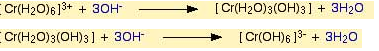
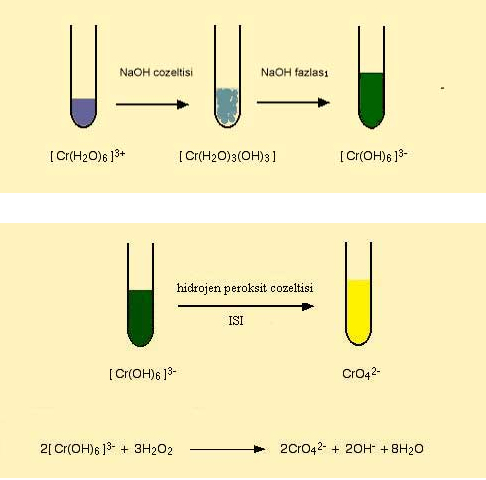
Fakat bu renk degisimi sadece ligand yer degistirmesi ile olusmamaktadir. Hekzaaaquakrom(III) bilesiginin hidronyum (OH-) iyonu ile reaksiyonu sonucunda çözeltinin renginde degisim olmaktadir. NaOH ile reaksiyona sokulan komplekste 3 su molekülü yapidan ayrilarak yerine 3 tane OH molekülü girer ve dikkat edilirse yüksüz bir bilesik elde edilir. Bu bilesik çöker. Ortama NaOH fazlasi eklendigi zaman olusan bu çökelek suda çok iyi çözündügü için tekrar çözülür ve OH iyonun fazlasi ile [Cr(OH)6]3- kompleksini oluşturur.
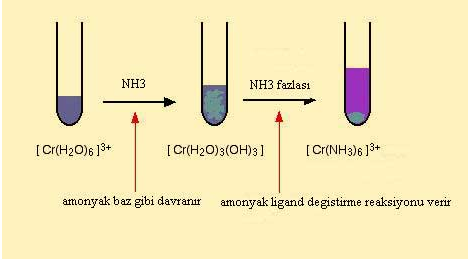
Hekzaaaquakrom (III) bilesiginin diger bir renk degisimi reaksiyonu iseamonyak ile verdigi kompleks reaksiyonudur. Amonyak hem baz hem ligand gibi davranma özelligine sahiptir. Hekzaaaquakrom (III) bilesiginin amonyakla verdigi reaksiyon sonucunda nötr bir bilesik olusur ve bu olusan bilesik çökelek olarak elde edilir.
Daha sonra amonyak çözeltisinin fazlasi eklenerek bilesikteki su molekülleri amonyak ile yer degistirerek hekzaaminkromat (III) kompleksini olustururlar.
02.02. Cr (III)'ün Cr (VI)'ya yükseltgenmesi
Hekzaaaquakrom(III) çözeltisine NaOH çözeltisinin fazlasinin eklenmesi sonucunda olusan [Cr(OH)6]3- kompleksine hidrojen peroksit eklenerek çözelti isitilir. Böylelikle Krom (III) Krom (VI)'ya yükseltgenir.
Hekzaaaquakrom(III) çözeltisine NaOH çözeltisinin fazlasinin eklenmesi sonucunda olusan [Cr(OH)6]3- kompleksine hidrojen peroksit eklenerek çözelti isitilir. Böylelikle Krom (III) Krom (VI)'ya yükseltgenir.
02.03. Kromat (VI) -Dikromat (VI) Dengesi
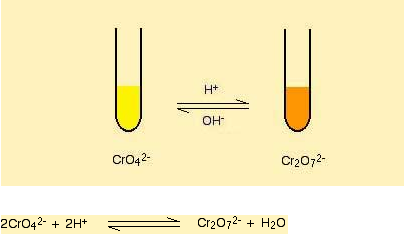
Kromat(VI) (CrO42-) çözeltisine seyreltik sülfürik asit eklenmesi ile dikromat (VI) (Cr2O72- ) elde edilebilir. Bu reaksiyonun terside geçerlidir. Yani dikromat (VI) çözeltisine sodyum hidroksit eklenmesi ile Kromat(VI) elde edilebilir.
Kromat(VI) (CrO42-) çözeltisine seyreltik sülfürik asit eklenmesi ile dikromat (VI) (Cr2O72- ) elde edilebilir. Bu reaksiyonun terside geçerlidir. Yani dikromat (VI) çözeltisine sodyum hidroksit eklenmesi ile Kromat(VI) elde edilebilir.
02.04. Dikromat iyonunun indirgenmesi
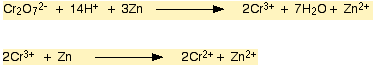
Dikroma (VI) iyonu (örnegin potasyum dikromat (VI) çözeltisi), krom (III) iyonuna çinko ve seyreltik hidroklorik veya sülfürik asit kullanilarak indirgenebilir.
03. Mangan (Mn)
Geçis elementlerinin 7B grup elemani olan mangani en önemli bilesigi titrasyonlarda oksitleyici ajan olarak kullanilan permanganattir.
3.1 Mn (III) İyonunun Sulu Çözeltilerinin Reaksiyonları
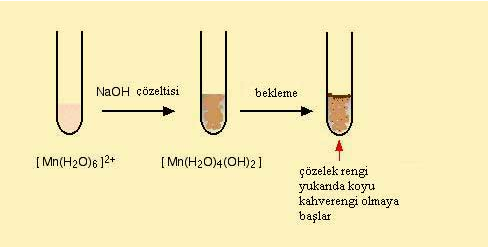
Mn(III) iyonu, hekzaaaquamangan(II) ([Mn(H2O)6]2+) kompleks bilesiginde bulunmaktadir.
Bu çözeltininhidroksi (OH-) iyonu iler reaksiyonu su sekilde gerçeklesir.
Hidroksi iyonu bilesikte ligand olarak bulunan su molekülünden hidrojen atomunu alarak mangana baglanir. Reaksiyonun sol tarafinda olusan bilesik yüksüzdür, suda çözünmez ve çökelek formunda bulunur.
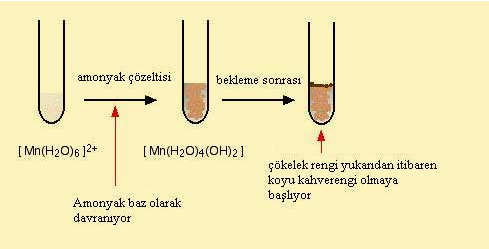
Hekzaaaquamangan (II) kompleks bilesiginin amonyak ile reaksiyonunda amonyak baz olarak davranir ve su ligantindaki bir protonu koparir.
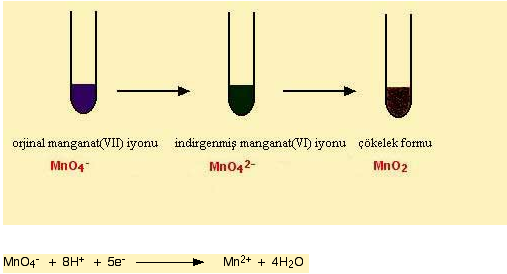
3.2. Potasyum Permanganat (VII) Kimyası
Potasyum permanganat çok kuvvetli bir oksitleyici ajandir. Organik kimyada da bir çok reaksiyonda kullanilmaktadir.
Potasyum permanganat çok kuvvetli bir oksitleyici ajandir. Organik kimyada da bir çok reaksiyonda kullanilmaktadir.
Yarı tepkimesi ile bir çok redoks tepkimesine katilmaktadir.
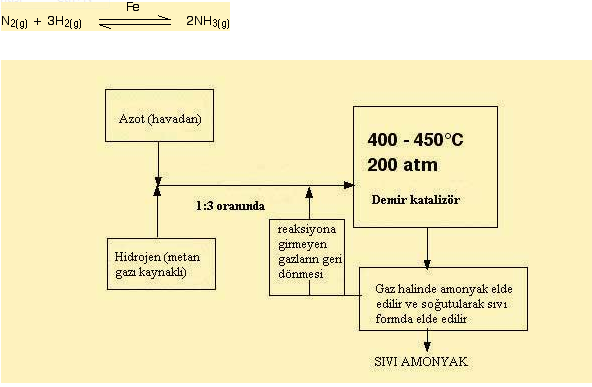
04. Demir
Geçis elementlerinden demir bir çok proseste katalizör görevi görmektedir. Bunlardan en önemlisi amonyak üretiminde üstlendigi katalizör görevidir.
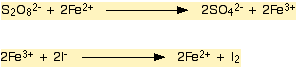
Diger bir reaksiyon ise persülfat iyonu ( S2O82-) ile iyot arasindaki reaksiyonda Fe (III) ve Fe (II) katalizör olarak kullanilir.
Yukaridaki reaksiyonun gerçeklesmesi için gerekli olan ara basamaklar asagidaki gibidir.
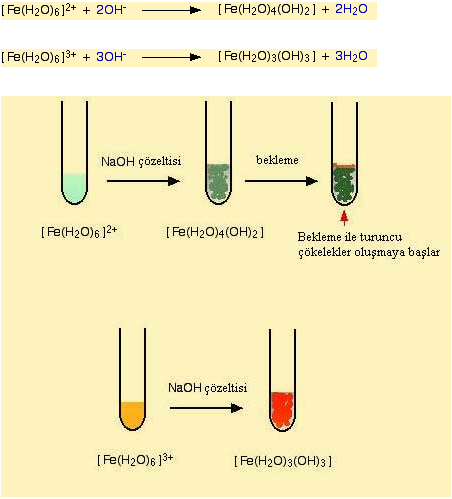
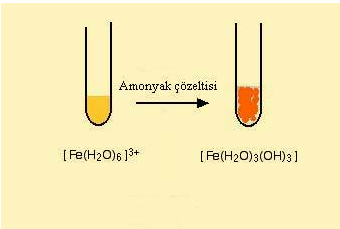
Demirin +2 ve +3 formda bulundugu bilesikler hakzaaquademir (II) ( [Fe(H2O)6]2+) ve hekzaaquademir (III) ([Fe(H2O)6]3+) bilesikleridir. Bu kompleks bilesiklerin su, hidroksi iyonu ve amonyak ile verdigi reaksiyonlar diger geçis elementlerin reaksiyonu ile benzerdir.
Fe (II) ve Fe (III) kompleks bilesigi sirasi ile hidronyum (OH-) iyonu ile reaksiyon verirken bilesikteki su ligandinin bir protonunu çekerek yapiya baglanir.
04.01. Demir iyonunun sulu çözeltilerinin reaksiyonları
Demirin +2 ve +3 formda bulundugu bilesikler hakzaaquademir (II) ( [Fe(H2O)6]2+) ve hekzaaquademir (III) ([Fe(H2O)6]3+) bilesikleridir. Bu kompleks bilesiklerin su, hidroksi iyonu ve amonyak ile verdigi reaksiyonlar diger geçis elementlerin reaksiyonu ile benzerdir.
Fe (II) ve Fe (III) kompleks bilesigi sirasi ile hidronyum (OH-) iyonu ile reaksiyon verirken bilesikteki su ligandinin bir protonunu çekerek yapiya baglanir.
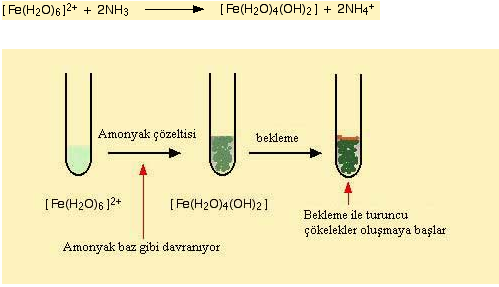
Amonyak bu tür kompleks bilesikleri ile reaksiyonunda hem baz hemde ligand gibi davranabilir fakat bu reaksiyonda su molekülünden proton uzaklastirmak için baz gibi davranir.
Demir (II) nin amonyak ile reaksiyonu asagidaki sekilde gerçeklesir.
Demir (II) nin amonyak ile reaksiyonu asagidaki sekilde gerçeklesir.
Demir (III) nin amonyak ile reaksiyonu ise
şeklindedir.
Kaynak: kimyaevi.org
Tanrı varsa eğer, ruhumu kutsasın... Ruhum varsa eğer!

 Geçiş Elementleri (Geçiş Metalleri)
Geçiş Elementleri (Geçiş Metalleri)