SODYUM VE SODYUMUN ÖZELLİKLERİ
Sembol: Na
Atom numarası:11
Atom ağırlığı: 22.989770 g/mol
Oda koşullarında (25°C 298 K): Gümüşümsü beyaz metalik katı
Alkali metal
s-blok elementi
Sodyum ilk olarak 1877 yılında Humphrey Davy tarafından sodyum hidroksitten elektroliz yolu ile izole edilmiştir.
Sodyum metali deniz suyunda çok miktarda bulunan NaCl tuzunun elektrolizi ile saf olarak elde edilir.
NaCl erime noktası 800°C den fazla olduğu için elektroliz ile saflaştırılması zor olduğundan NaCl (40%) ve CaCl2 (60%) karışımı kullanılarak erime noktası 580 Cye düşürülür. Bu karışımın elektrolizi ile Na saf olarak elde edilir.
Katot: Na+(s) + e- à Na (s)
Anot: Cl-(s) à 1/2Cl2 (g) + e
Tabiatta ya deniz suyundan çözülmüş (deniz tuzu) yada toprak içinde billurlarmış olarak (kaya tuzu) klorür halinde, bazen nitrat halinde (şili güherçilesi) veya deniz bitkilerinde organik asitlerle birleşmiş halde çok yaygın olarak bulunan alkali maden.
Meterol. Sodyum bulutu, çok yükseklerdeki rüzgarları, belli bir yükseltide bir füze tarafından yayılan sodyum kütlesinden yararlanılarak ölçme metodu; yayılan sodyum kütlesi flüorışıl hale gelir; bunların yer tarafından izlenen evrimi, atmosferi yer tarafından izlenen evrimi, atmosferin en yüksek bölgelerindeki rüzgarların veya iyonosfer rüzgarlarının evrimini incelenmesini sağlar. (Bu usulle ancak alaca karanlıkta ölçüler yapılabilir. İyonosfer rüzgarlarının ölçülmesi için 1964de ortaya çıkartılan yeni bir usul, ölçümleri Centaure füzeleri tarafından püskürtülen trimetil alüminyum yardımıyla, gece yapılmasını sağlamıştır.)
ANSİKL.Kim. Sodyum (esk.natriyum) atom numarası 11,atom ağırlığı Na=21,0 olan kimyasal elementtir.Alkali madenler grubunda, lityum ile potasyum arasında yer alır.1807de, sodyum hidroksidin elektrolizi sayesinde Davy tarafından keşfedildi.Dövülgen ve yumuşak bir madendir; kırık yüzeyleri yeni olduğu zaman parlak beyaz renktedir, fakat havada hızla oksitlenerek donuklaşır.097, yoğunluğundadır, 98 derece Cta erir. 880 derece Cta kaynar hava etkisinden korumak için vazelin yağı veya gaz yağı içinde saklanır.
Çok kolay yükseldiğinden ametallerin birçoğuyla, özellikle hidrojenle, halojenlerle, kükürtle birleşir. Güçlü bir indirgendir: soğukta, hidrojen ve sodyum hidroksit vererek suyu ve birçok oksijenli ve halojenli bileşiği ayrıştırır. İçinde belirli birçok bileşiğin bulunabildiği bir malkama vererek civa içinde çözünür.
Ergemiş sodyum klorürün veya sodyum hidroksitin elektrolizinden veya sodyum karbonatın kömürle indirgenmesinden elde edilir. Sodyum, indirgen olarak kullanılır, mesela silisyum ve borun hazırlanmasını sağlar ve organik kimyada birçok uygulaması vardır. Ayrıca sodyum peroksitin (oksilit) üretiminde de kullanılır. Malgaması hidrojenleyici olarak işe yarar.
Sodyum bileşikleri. Sodyum, oksijeni birleşerek NaO protoksidini ve NaO peroksitini verir. Sodyum protoksit veya sutkostik NaOH veren bazik bir oksittir. Sodyum peroksit oksijen vererek su etkisi ile ayrışır (Bk.Oksilit) ve asitlerle oksijenli su (Hidrojen peroksit) verir.
Sodyum hidroksit veya sud kostik NaOH. 320 derece Cte a eriyen beyaz bir katıdır; akkor derecede uçucudur, suda ısı yayarak çözünür ve nem kaparak bozunur. Potasyum hidroksitle aynı özellikleri gösteren fakat ondan daha az yakıcı olan güçlü bir bazdır. Sodyum klorür çözeltisinin elektrolizi ile elde edilen, maddelerin birbirine etki etmesinden sakınarak, klor ile birlikte hazırlanır. Kirecin sodyum karbonata etkilemesiyle de elde edilebilir.
Günümüzde kullanılan solvey usulünde , derişik sodyum klorür çözeltisi amonyum hidrojen karbonatla (veya bileşenleri olan karbon dioksit veya amonyakla) birleşerek erimiş amonyum klorür ve çözünürlüğü az olan sodyum ikarbonat verir; dibe çökelen sodyum bikarbonat kavrularak nötür karbonat halinde dönüşür. Bu tepkimeler formülle şöyle gösterilebilir.
NaCI + CO + HO = NH
® NaHCO + NHCI;
2NaHCO ®NaCO+HO + CO
Amonyum klorürü kireçle işleyerek amonyağı toplamak mümkündür. Kireç, işlem için karbon dioksit gerektiği zaman, kireç taşının kavrulması ile elde edilebilir.
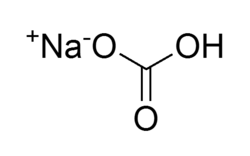
Sodyum karbonat 10 mol su alarak, havada çiçeklenen klinorombik prizmalar halinde billurlaşır. Ayrışmadan erir. Sudaki çözeltisi güçlü bir alkali tepkime verir. Ayrıca sodyum karbonat, sanayide daha pahalı olan sodyum hidroksidin yerini almıştır. Camcılıkta ve birçok sodyum bileşiğinin üretiminde, çamaşırcılıkta, boyacılıkta, suların hazırlanmasında kullanılır. Sodyum hidrojen karbonat veya bikarbonata NaHCO Vichy tuzu da denir. Ve karbon dioksidin nötür sodyum karbonata etkimesi ile hazırlanır. Isıtılınca notür sodyum karbonat ile karbon dioksidin ayrışır. Tıpta ve seltz hazırlanmasında kullanılır.
Nötür sodyum sülfür NaS ve asit sodyum sülfür Na HS, kükürtlü hidrojenin sodyum hidrokside etkimesi ile meydana gelir. Kükürt ile ısıtılınca, suni kükürt banyolarının hazırlanmasında kullanılan polisülfürleri verir.
Sodyum sülfata NaSO bazı inorganik kaynaklarda rastlanır. 10 mol su alarak renksiz ve hacimli klinorombik prizmalar halinde (Glauber tuzu) billurlaşır ve havada çiçeklenir ayrışmadan erir. Pencere camlarının hazırlanmasında kullanılır; tıpta mushil olarakta kullanılır. Sülfüroz asit gibi, bu bileşiklerde indirgen ve renk gidericidir. Sodyum hidrit NaNO sodyum nitrattan hazırlanır ve 217 derece Cte eriyen renksiz bir katıdır. Diazon boyar maddelerinin hazırlanmasında kullanılır. Boratlar arasında, en önemlisi borakstır. NaBO.
Sodyum tuzlarının özellikleri. Hemen hemen hepsi suda çözünür; az çözümlenenler arasında, ancak periyodat ile proantimonyat sayılabilir. Hepsi Bunsen bekinin alevini sarıya boyar.
Biyokim. Sodyum, hücrelerde ve dokulardaki su metobolizmasında ve organik sıvıların asit-bas dengesini sağlamakta önemli bir rol oynar. Dokulardakine yakın bir derişilikte, böbrekler tarafından organizmadan atılır. Potasyum iyonları ile sodyum iyonları arasında bir denge vardır ve bu denge sayesinde potasyum sodyumu etkisiz hale getirir ve sodyumun dışarı atılmasını yol açar: bu sidik söktürünce etkiden, birçok hastalığın tedavisinde veya bazı ilaç tedavileri sırasında yararlanılır.
Eczc. Tedavide birçok sodyum tuzu kullanılır.
Zayıf asitlerin sodyum tuzları (bikarbonat, karbonat, borat) alkalidir ve alkali oldukları oranda kullanılır. Öbür sodyum tuzlarının tıpta kullanılma özellikleri asit köklerine bağlıdır.
Sodyum Bileşikleri ve Özellikleri
Sponsorlu Bağlantılar
Atom numarası:11
Atom ağırlığı: 22.989770 g/mol
Oda koşullarında (25°C 298 K): Gümüşümsü beyaz metalik katı
Alkali metal
s-blok elementi
Sodyum ilk olarak 1877 yılında Humphrey Davy tarafından sodyum hidroksitten elektroliz yolu ile izole edilmiştir.
Sodyum metali deniz suyunda çok miktarda bulunan NaCl tuzunun elektrolizi ile saf olarak elde edilir.
NaCl erime noktası 800°C den fazla olduğu için elektroliz ile saflaştırılması zor olduğundan NaCl (40%) ve CaCl2 (60%) karışımı kullanılarak erime noktası 580 Cye düşürülür. Bu karışımın elektrolizi ile Na saf olarak elde edilir.
Katot: Na+(s) + e- à Na (s)
Anot: Cl-(s) à 1/2Cl2 (g) + e
Tabiatta ya deniz suyundan çözülmüş (deniz tuzu) yada toprak içinde billurlarmış olarak (kaya tuzu) klorür halinde, bazen nitrat halinde (şili güherçilesi) veya deniz bitkilerinde organik asitlerle birleşmiş halde çok yaygın olarak bulunan alkali maden.
Meterol. Sodyum bulutu, çok yükseklerdeki rüzgarları, belli bir yükseltide bir füze tarafından yayılan sodyum kütlesinden yararlanılarak ölçme metodu; yayılan sodyum kütlesi flüorışıl hale gelir; bunların yer tarafından izlenen evrimi, atmosferi yer tarafından izlenen evrimi, atmosferin en yüksek bölgelerindeki rüzgarların veya iyonosfer rüzgarlarının evrimini incelenmesini sağlar. (Bu usulle ancak alaca karanlıkta ölçüler yapılabilir. İyonosfer rüzgarlarının ölçülmesi için 1964de ortaya çıkartılan yeni bir usul, ölçümleri Centaure füzeleri tarafından püskürtülen trimetil alüminyum yardımıyla, gece yapılmasını sağlamıştır.)
ANSİKL.Kim. Sodyum (esk.natriyum) atom numarası 11,atom ağırlığı Na=21,0 olan kimyasal elementtir.Alkali madenler grubunda, lityum ile potasyum arasında yer alır.1807de, sodyum hidroksidin elektrolizi sayesinde Davy tarafından keşfedildi.Dövülgen ve yumuşak bir madendir; kırık yüzeyleri yeni olduğu zaman parlak beyaz renktedir, fakat havada hızla oksitlenerek donuklaşır.097, yoğunluğundadır, 98 derece Cta erir. 880 derece Cta kaynar hava etkisinden korumak için vazelin yağı veya gaz yağı içinde saklanır.
Çok kolay yükseldiğinden ametallerin birçoğuyla, özellikle hidrojenle, halojenlerle, kükürtle birleşir. Güçlü bir indirgendir: soğukta, hidrojen ve sodyum hidroksit vererek suyu ve birçok oksijenli ve halojenli bileşiği ayrıştırır. İçinde belirli birçok bileşiğin bulunabildiği bir malkama vererek civa içinde çözünür.
Ergemiş sodyum klorürün veya sodyum hidroksitin elektrolizinden veya sodyum karbonatın kömürle indirgenmesinden elde edilir. Sodyum, indirgen olarak kullanılır, mesela silisyum ve borun hazırlanmasını sağlar ve organik kimyada birçok uygulaması vardır. Ayrıca sodyum peroksitin (oksilit) üretiminde de kullanılır. Malgaması hidrojenleyici olarak işe yarar.
Sodyum bileşikleri. Sodyum, oksijeni birleşerek NaO protoksidini ve NaO peroksitini verir. Sodyum protoksit veya sutkostik NaOH veren bazik bir oksittir. Sodyum peroksit oksijen vererek su etkisi ile ayrışır (Bk.Oksilit) ve asitlerle oksijenli su (Hidrojen peroksit) verir.
Sodyum hidroksit veya sud kostik NaOH. 320 derece Cte a eriyen beyaz bir katıdır; akkor derecede uçucudur, suda ısı yayarak çözünür ve nem kaparak bozunur. Potasyum hidroksitle aynı özellikleri gösteren fakat ondan daha az yakıcı olan güçlü bir bazdır. Sodyum klorür çözeltisinin elektrolizi ile elde edilen, maddelerin birbirine etki etmesinden sakınarak, klor ile birlikte hazırlanır. Kirecin sodyum karbonata etkilemesiyle de elde edilebilir.
Günümüzde kullanılan solvey usulünde , derişik sodyum klorür çözeltisi amonyum hidrojen karbonatla (veya bileşenleri olan karbon dioksit veya amonyakla) birleşerek erimiş amonyum klorür ve çözünürlüğü az olan sodyum ikarbonat verir; dibe çökelen sodyum bikarbonat kavrularak nötür karbonat halinde dönüşür. Bu tepkimeler formülle şöyle gösterilebilir.
NaCI + CO + HO = NH
® NaHCO + NHCI;
2NaHCO ®NaCO+HO + CO
Amonyum klorürü kireçle işleyerek amonyağı toplamak mümkündür. Kireç, işlem için karbon dioksit gerektiği zaman, kireç taşının kavrulması ile elde edilebilir.
Sodyum karbonat 10 mol su alarak, havada çiçeklenen klinorombik prizmalar halinde billurlaşır. Ayrışmadan erir. Sudaki çözeltisi güçlü bir alkali tepkime verir. Ayrıca sodyum karbonat, sanayide daha pahalı olan sodyum hidroksidin yerini almıştır. Camcılıkta ve birçok sodyum bileşiğinin üretiminde, çamaşırcılıkta, boyacılıkta, suların hazırlanmasında kullanılır. Sodyum hidrojen karbonat veya bikarbonata NaHCO Vichy tuzu da denir. Ve karbon dioksidin nötür sodyum karbonata etkimesi ile hazırlanır. Isıtılınca notür sodyum karbonat ile karbon dioksidin ayrışır. Tıpta ve seltz hazırlanmasında kullanılır.
Nötür sodyum sülfür NaS ve asit sodyum sülfür Na HS, kükürtlü hidrojenin sodyum hidrokside etkimesi ile meydana gelir. Kükürt ile ısıtılınca, suni kükürt banyolarının hazırlanmasında kullanılan polisülfürleri verir.
Sodyum sülfata NaSO bazı inorganik kaynaklarda rastlanır. 10 mol su alarak renksiz ve hacimli klinorombik prizmalar halinde (Glauber tuzu) billurlaşır ve havada çiçeklenir ayrışmadan erir. Pencere camlarının hazırlanmasında kullanılır; tıpta mushil olarakta kullanılır. Sülfüroz asit gibi, bu bileşiklerde indirgen ve renk gidericidir. Sodyum hidrit NaNO sodyum nitrattan hazırlanır ve 217 derece Cte eriyen renksiz bir katıdır. Diazon boyar maddelerinin hazırlanmasında kullanılır. Boratlar arasında, en önemlisi borakstır. NaBO.
Sodyum tuzlarının özellikleri. Hemen hemen hepsi suda çözünür; az çözümlenenler arasında, ancak periyodat ile proantimonyat sayılabilir. Hepsi Bunsen bekinin alevini sarıya boyar.
Biyokim. Sodyum, hücrelerde ve dokulardaki su metobolizmasında ve organik sıvıların asit-bas dengesini sağlamakta önemli bir rol oynar. Dokulardakine yakın bir derişilikte, böbrekler tarafından organizmadan atılır. Potasyum iyonları ile sodyum iyonları arasında bir denge vardır ve bu denge sayesinde potasyum sodyumu etkisiz hale getirir ve sodyumun dışarı atılmasını yol açar: bu sidik söktürünce etkiden, birçok hastalığın tedavisinde veya bazı ilaç tedavileri sırasında yararlanılır.
Eczc. Tedavide birçok sodyum tuzu kullanılır.
Zayıf asitlerin sodyum tuzları (bikarbonat, karbonat, borat) alkalidir ve alkali oldukları oranda kullanılır. Öbür sodyum tuzlarının tıpta kullanılma özellikleri asit köklerine bağlıdır.
Sodyum Bileşikleri ve Özellikleri
Son düzenleyen Safi; 27 Eylül 2016 01:43

 Elementler - Sodyum
Elementler - Sodyum