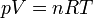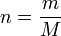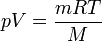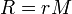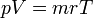İdeal Gaz Yasası
MsXLabs.org & Vikipedi, özgür ansiklopedi
İdeal gaz yasası, sadece teoride olan ideal gazların durumları hakkında denklemler sağlayan bir yasadır. Bir miktar gazın durumu; basıncı, hacmi ve sıcaklığına göre belli olur. Bu denklem aşağıdaki gibidir:
İdeal gaz yasası, en çok monatomik gazlar için geçerlidir ve yüksek sıcaklık, alçak basınçlarda daha iyi sonuçlar verir. Bu formül, her gaz molekülünün boyutunu ya da moleküller arası bağları dikkate almadığından, bunları da dikkate alan van der Waals denklemi daha iyi sonuçlar verir.
Alternatif Halleri
Mol sayısı (n), kütle olarak da verilebileceği için, bazen bu denklemin alternatif hali daha kullanışlı olabilir. Bu özellikle bilinen bir gaz sorulduğunda kolaylık sağlar.
Mol sayısının (n), kütlenin (m) molar kütleye (M) bölünmesine eşit olduğunu düşünün:
Kanıt

MsXLabs.org & Vikipedi, özgür ansiklopedi
Sponsorlu Bağlantılar
İdeal gaz yasası, sadece teoride olan ideal gazların durumları hakkında denklemler sağlayan bir yasadır. Bir miktar gazın durumu; basıncı, hacmi ve sıcaklığına göre belli olur. Bu denklem aşağıdaki gibidir:
- P paskal olarak basınç,
- V kübik metre olarak hacim,
- n gazın mol sayısı,
- R gaz sabiti (8.3145 J/(mol K))
- T de Kelvin olarak sıcaklıktır.
İdeal gaz yasası, en çok monatomik gazlar için geçerlidir ve yüksek sıcaklık, alçak basınçlarda daha iyi sonuçlar verir. Bu formül, her gaz molekülünün boyutunu ya da moleküller arası bağları dikkate almadığından, bunları da dikkate alan van der Waals denklemi daha iyi sonuçlar verir.
Alternatif Halleri
Mol sayısı (n), kütle olarak da verilebileceği için, bazen bu denklemin alternatif hali daha kullanışlı olabilir. Bu özellikle bilinen bir gaz sorulduğunda kolaylık sağlar.
Mol sayısının (n), kütlenin (m) molar kütleye (M) bölünmesine eşit olduğunu düşünün:
Bunu, n ile yer değiştirirsek:
Termodinamik ve fizik alanlarında, bir şey spesifik olması gerekiyorsa, bu değerlerin birim başına düşen kütle halinde verilmesi gerektiği anlamına gelir. Bu durumda spesifik gaz sabiti (r), gaz sabitinin (R) molar kütleye (M) bölünmesi anlamına gelir:
Bu durumda, yukardaki formüle r eklenmek istense, aşağıdaki formül ortaya çıkar:veya
Yoğunluk (ρ) kütlenin hacme oranı olduğundan, hacim kütleyle yer değiştirirse (V = g/ρ), benzer bir formül yazılabilir.
Kanıt
Uygulamalı

Teorikİdeal gaz yasası, ayrıca, kinetik teoriyi kullanarak kanıtlanılabilir. Bunda, durumu basitleştirmek için bazı varsayımların yapıldığı unutulmamalıdır. Bunların arasında en önemlisi şudur: bir gazın molekülleri ya da atomları bir kütleye sahip olsalar da yok sayılabilirler.
Tanrı varsa eğer, ruhumu kutsasın... Ruhum varsa eğer!

 Gaz Yasaları - İdeal Gaz Yasası
Gaz Yasaları - İdeal Gaz Yasası