Redoks Tepkimeleri Ve Eşitlenmesi:
Redoks (oksidoredüksiyon) ingilizce
reduction (indirgenme) ve
oxidation (yükseltgenme) kelimelerinin kısaltılmasından elde edilmiş bir kelime olup elektron alış-verişinin olduğu kimyasal tepkimeleri belirtmek için kullanılır.
Redoks Tepkimeleri
İki çeşit redoks tepkimesi vardır:
- Yükseltgenme bir atom, iyon ya da molekülün elektron kaybına uğradığı tepkimelerdir.
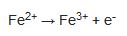
- İndirgenme bir atom, iyon ya da molekülün elektron aldığı tepkimelerdir.
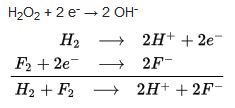
Yukarıdaki redoks tepkimesinde
H (hidrojen) yükseltgenmekte,
F (flor) ise indirgenmektedir. Bu yüzden tepkimede
H indirgen,
F ise yükseltgen özelliktedirler.
Bir elektokimyasal hucrede akim gecerken olctugun voltaj o hucreyi olusturan anodun yukselgenme potansiyeli ile katodun indirgenme potansiyellerinin toplamidir, eger bu degerleri ayri ayri bulmak istiyorsan onlari standart elektrotlar olarak bilinen hidrojen veya kalomel elektrota karsi olcmen gerekir....
 (Redoks Tepkimesi)
(Redoks Tepkimesi)
İki yarı pil tepkimesinin yükseltgenme potansiyelleri verildiği zaman potansiyeli büyük olan her zaman anot, küçük olan ise katot olacak şekilde tepkimeler düzenlenerek (küçük olan ters çevrilerek) pil tepkimesi ve potansiyeli hesaplanabilir.
Pillerde redoks tepkimeleri olur. Bu tepkimeler indirgenme yükseltgenme reaksiyonlarıdır haliyle. Eğer indirgenen ve yükseltgenen maddelerin E0 yani Elektron gerilim ölçümü olan volt cinsinden değeri verilirse değeri büyük olan yani potansiyeli büyük olan anot küçük olan ise katot olacak şekilde adlandırılır. Tepkimeler bu şekilde düzenlendikten sonra küçük olan ters çevrilerek(eksi ile çarpılarak) büyük olan ile toplandığında redoksun potansiyel enerjisi hesaplanmş olur.
Ayrıca bir tepkime ters çevrildiğinde E0 değeri işaret değiştir. Eğer tepkimeleri eşitlemek için çarpan kullanılyorsa E0 bu sayılarla çarpılmaz. Çünkü E0 pilin büyüklüğüne(miktarına) bağlı değil ortamdaki derişimle ilintilidir.
Örneğin içinde Zn ve Ag bulunan bir pil düşünelim.
Zn ..................... Zn+2 + 2e- E0 = 0,7 volt
Ag ..................... Ag+ + e- E0 = -0,8 volt
gibi değerler verilrse önce tükseltgenme gerilimine bakılır Zn'nin Ag'den büyük olduğu görülür. Zn anot Ag ise katottur. Zn tepkimesini aynen alıp Ag'yi iki ile çarparak ters çevirirsek
Zn..........Zn+2 + 2e- E0 = 0,76 volt
2Ag+ + 2e- ............. Ag E0= 0,80 volt
Zn + 2Ag+ .............. Zn+2 + 2Ag E pil = 1,56 volt olarak bulunur.