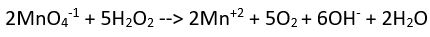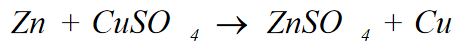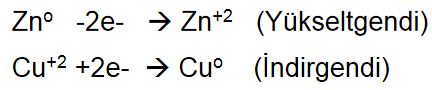Ziyaretçi
yükseltgeme-indirgeme tepkimesi
REDOKS TEPKİMESİ olarak da bilinir, çoğunlukla bir maddeden öbürüne oksijen atomları, hidrojen atomları ya da elektron aktarımı biçiminde gerçekleşen çok çeşitli kimyasal süreçlerin ortak adı.
Sponsorlu Bağlantılar
Elektronların kimyasal tepkimelerdeki rolü anlaşılmadan önce, karbonun yanması
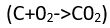 ya da demirin paslanmasında
ya da demirin paslanmasında 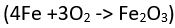 olduğu gibi, bir elementin oksijenle birleştiği tepkimeler yükseltgeme; bakır oksitin hidrojenle indirgenmesinde
olduğu gibi, bir elementin oksijenle birleştiği tepkimeler yükseltgeme; bakır oksitin hidrojenle indirgenmesinde 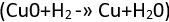 olduğu gibi bir elementin oksijen kaybettiği tepkimeler ise indirgeme olarak adlandırılırdı.
olduğu gibi bir elementin oksijen kaybettiği tepkimeler ise indirgeme olarak adlandırılırdı.Bugün çoğu yükseltgeme-indirgeme tepkimelerinde oksijen atomları, hidrojen atomları ya da elektronların aktarıldığı anlaşılmıştır. Bu tepkimelerin her ikisi bir arada gerçekleşir; yani yükseltgeme tepkimesi yürürken aynı anda indirgeme tepkimesi de yürür. Örneğin
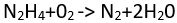 tepkimesinde, hidrazin hidrojen kaybederek azot gazına yükseltgenirken, oksijen hidrojen kazanarak indirgenir ve su oluşturur.
tepkimesinde, hidrazin hidrojen kaybederek azot gazına yükseltgenirken, oksijen hidrojen kazanarak indirgenir ve su oluşturur.Birçok madde sulu çözeltilerinde iyonlaşır. Örneğin nikel klorür,
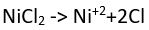 tepkimesinde görüldüğü gibi, yüklü bileşenlerine ayrışır. Bu tür çözeltilerin elektrolizinde anotta yükseltgeme tepkimesi, katotta ise indirgeme tepkimesi gerçekleşir. Nikel klorürün elektrolizinde,
tepkimesinde görüldüğü gibi, yüklü bileşenlerine ayrışır. Bu tür çözeltilerin elektrolizinde anotta yükseltgeme tepkimesi, katotta ise indirgeme tepkimesi gerçekleşir. Nikel klorürün elektrolizinde, 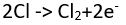 anot tepkimesi,
anot tepkimesi, 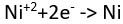 ise katot tepkimesidir. Elektron aktarımına dayalı bu tepkimeler yarı tepkimeler ya da yükseltgeme-indirgeme çiftleri olarak adlandırılır. Kuramsal olarak her yükseltgeme-indirgeme tepkimesi elektron aktarımı mekanizmasını gösteren iki çifte ayrılabilir. Yükseltgeme ve indirgeme aynı anda ve eşdeğer miktarlarda gerçekleşir; yani kaybedilen elektron sayısı kazanılan elektron sayısına eşittir. Bu iki çiftin göreli potansiyelleri tepkimenin hangi yönde ilerleyeceğini belirler.
ise katot tepkimesidir. Elektron aktarımına dayalı bu tepkimeler yarı tepkimeler ya da yükseltgeme-indirgeme çiftleri olarak adlandırılır. Kuramsal olarak her yükseltgeme-indirgeme tepkimesi elektron aktarımı mekanizmasını gösteren iki çifte ayrılabilir. Yükseltgeme ve indirgeme aynı anda ve eşdeğer miktarlarda gerçekleşir; yani kaybedilen elektron sayısı kazanılan elektron sayısına eşittir. Bu iki çiftin göreli potansiyelleri tepkimenin hangi yönde ilerleyeceğini belirler.En güçlü indirgeyici maddeler, soy metal bileşiklerini kolaylıkla indirgeyebilen ve aynı zamanda sudan hidrojen açığa çıkaran sodyum gibi elektropozitiflik değeri çok yüksek metallerdir. Sudan kolaylıkla oksijen gazı çıkaran flüor ve ozon gibi maddeler ise en güçlü yükseltgeyici maddeler arasındadır.
Bir yükseltgeme-indirgeme tepkimesinde yer alan her atomun elektron fazlasını ya da eksiğini gösteren bir yükseltgenme durumu vardır. Örneğin, sodyum iyonunun (Na+) bir elektron eksiği olduğundan yükseltgenme durumu -Fldir. Sülfat iyonunun (SO4) yükseltgenme durumu ise bileşen elementlerinin yükseltgenme durumlarının toplamına eşittir ve -2dir. Her oksijen atomunun iki fazla elektronu vardır; bu nedenle bunların sülfatın yükseltgenme durumuna toplam katkısı -8dir. Kükürtün yükseltgenme durumu ise +6dır; bu ikisi toplandığında sülfat iyonunun toplam yükseltgenme durumu 2 olarak bulunur. Sodyum sülfat
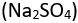 gibi elektronlar bakımından yüksüz olan bir maddede ise bileşenlerin yükseltgenme durumlarının toplamı sıfırdır. Bu durumda, iki sodyum atomunun yükseltgenme durumu (toplam +2), sülfat iyonunun yükseltgenme durumunu (2) dengeler. Böylece bir atom ya da iyon yükseltgenme durumu büyüdüğünde elektron kaybederek yükseltgenmiş, yükseltgenme durumu küçüldüğünde ise indirgenmiş olur.
gibi elektronlar bakımından yüksüz olan bir maddede ise bileşenlerin yükseltgenme durumlarının toplamı sıfırdır. Bu durumda, iki sodyum atomunun yükseltgenme durumu (toplam +2), sülfat iyonunun yükseltgenme durumunu (2) dengeler. Böylece bir atom ya da iyon yükseltgenme durumu büyüdüğünde elektron kaybederek yükseltgenmiş, yükseltgenme durumu küçüldüğünde ise indirgenmiş olur.Bazı elementlerin bütün bileşiklerinde aynı yükseltgenme durumunda bulunmalarına karşılık, başta ametaller ve geçiş elementleri olmak üzere birçok element çeşitli bileşiklerinde değişik yükseltgenme durumlarında bulunabilir. Örneğin, elementler arasında elektronegatifliği en yüksek olan flüor bütün bileşiklerinde -1 yükseltgenme durumundadır. Azotun yükseltgenme durumu ise amonyakta (NH3) olduğu gibi 3 ile nitrik asitte (HNO3) olduğu gibi +5 arasında değişir. Birden çok yükseltgenme durumunda bulunan elementlerin oluşturduğu inorganik bileşiklerin adlandırılmasında, elementin ardından sonra romen rakamıyla yükseltgenme durumu yazılır; örneğin, demir II klorür
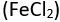 ve demir III klorür
ve demir III klorür  gibi.
gibi.kaynak: Ana Britannica
Son düzenleyen Safi; 26 Şubat 2017 18:55

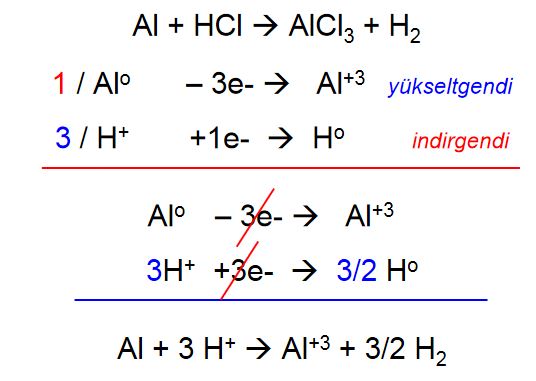
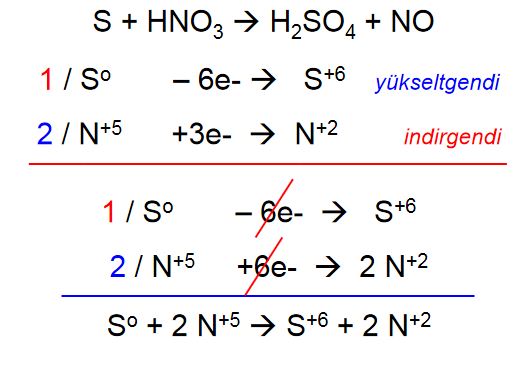
 Yükseltgenme-İndirgenme (Redoks) Tepkimeleri
Yükseltgenme-İndirgenme (Redoks) Tepkimeleri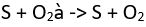
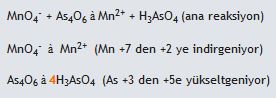
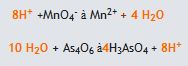
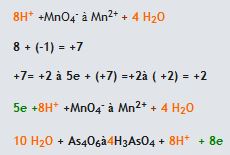
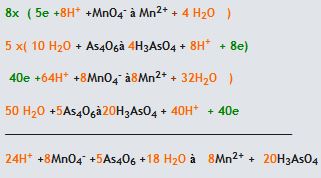
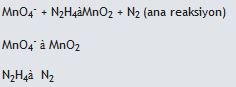
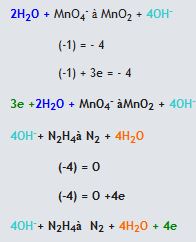
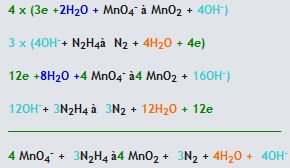

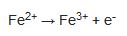
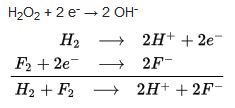
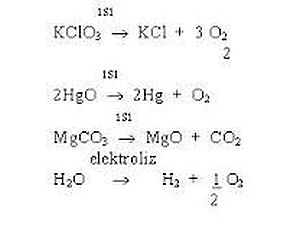
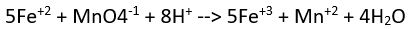
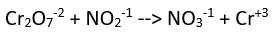 (asidik ortam)
(asidik ortam)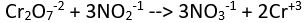
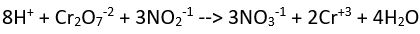
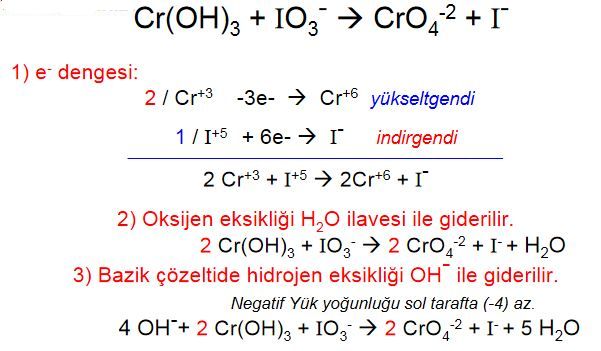
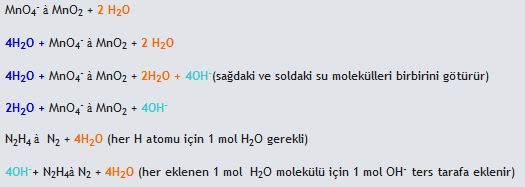
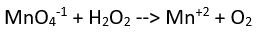 (bazik ortam)
(bazik ortam)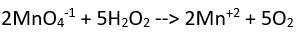 Yük denkliği ==>-2= 2x2 (denkliğin sağlanabilmesi için sağ tarafa 6OH- sol tarafa ve hidrojen oksijen denkliği için 2H2O eklenmelidir)
Yük denkliği ==>-2= 2x2 (denkliğin sağlanabilmesi için sağ tarafa 6OH- sol tarafa ve hidrojen oksijen denkliği için 2H2O eklenmelidir)