OSMOZ, OSMOTİK BASINÇ
Bir cam kap içine oturtulmuş gözenekli bir kabın içinde şekerli su, cam kapla da saf su bulunsun ve her iki kapta düzeyler aynı olsun (şek. 1).
Bu koşullar altında şeker yavaş yavaş gözenekli cidardan geçecek, gözenekli kabın suyu daha az şekerli olacak ve cam kabınki daha çok şekerli hale gelecektir. Bu olay, gözenekli cidarın iki yanındaki suyun aynı ölçüde şekerli hale gelinceye kadar sürecektir. Bu cidar arasından şekerin dıfüzyonu vaki olmuştur.
Bu kez gözenekli kabın cidarının, suyu geçirmekle birlikte şekeri geçirmediğini farz edelim. Şekerin bu difüzyonu artık vaki olmayacaktır. Bu sonuç şöyle ifade edilebilir: gözenekli cidar şekerin difüzyonuna engel olmaktadır ve dolayısıyla şekerin bu cidar üzerine bîr basınç icra ettiği kabul edilecektir; bu basınç, onun dışa difüze olmasına mani olan kabın cidarına bir gazın icra ettiği basınca benzer.
Bu basınca
osmotik basınç - osmoz basıncı adı verilir ve üzerinde belirdiği cidarlar da yan geçirgen cidarlar olmaktadır. (Bu yan geçirgenlik bitkisel hücrelerin cidarlarında var olduğu gibi deneysel olarak da meydana getirilebilir).
Son şekli Vant' Hoff (1885) tarafından verilmiş osmoz kanunları, osmotik basıncın ne yolla dört değişkene bağlı olduğunu saptamaktadır.
Bu değişkenler konsantrasyon, sıcaklık, erimiş maddenin tabiatı ve eritenin tabiatıdır.
Her şey aynı kalmak kaydıyla osmotik basınç eriten maddenin tabiatına (cinsine) bağlı değildir. Ama buna karşılık konsantrasyonla orantılıdır; konsantrasyonun v moleküler yoğunlukla ifade edilmesinde kanun
v.p = sabit (p = osmotik basınç) şeklinde konabilir.
Bu sabite, erimiş cisimle sıcaklığa bağlıdır. Burada bu formülün Böyle - Mariotte
V.P = Sabit
kanunuyla benzerliğine dikkat edilecektir. Burada da sabite, gazın cinsiyle sıcaklığa bağlıdır.
Yine her şey sabit kalmak kaydıyla osmotik basınç
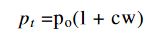
denklemi gereğince sıcaklıkla değişmektedir. Burada t, sıcaklık; p, \epa da sırasıyla bu sıcaklıkta ve sıfır derecede bir eriyikin osmotik basıncıdır; a'nın ise değeri, erimiş cismin cinsine tâbi olmaksızın 1/273'e eşittir, tıpkı gazlardaki benzer katsayı gibi.
Burada da Gay - Lussac kanunuyla benzerlik aşikâr oluyor: bir gazın
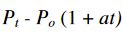
basıncı, sıcaklığına bağlıdır.
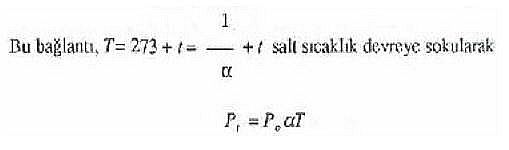
şeklinde de yazılabilir. Aynı şekilde, osmotik basınç için
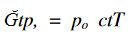
bağlantısı kurulur: osmotik basınç, salt sıcaklıkla orantılıdır.
Şimdi moleküler konsantrasyon ve sıcaklığın aynı zamanda değiştiğini farz edelim:
M konsantrasyonunda (yani belli bir hacimde erimiş cismin molekül sayısı) ve
T salt sıcaklığında osmotik basınçp;
v ve T ile de
p olsun. Yukarıdaki kanunlar gereğince
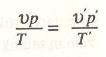
olur.
Bu oranların müşterek değerleri r ile gösterilebilir; bunun büyüklüğü sadece erimiş cismin cinsine bağlı olur. Bu takdirde bağlantı
vp=rT şeklinde yazılır ki bu da
VP=RT gazlar denklemiyle ayniyeti meydana koyar.
Yukarıdaki kanun bir başka şekle de konabilir: r sabitesinin, moleküler ağırlıkları altında ele alınmış bütün erimiş cisimler için aynı olduğu söylenebilir. Bu şekliyle gazlar için Avogadro kanunuyla tamamen benzer durumda olmaktadır.