Ziyaretçi
OSMOZ
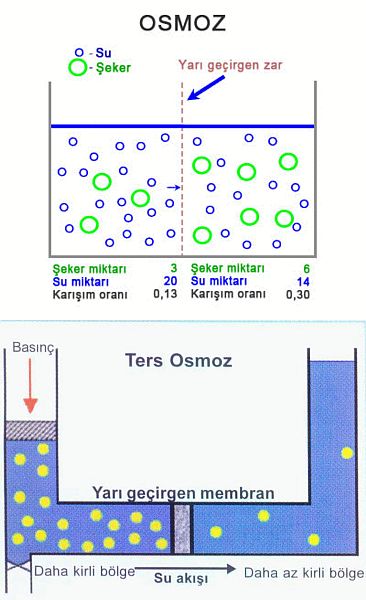
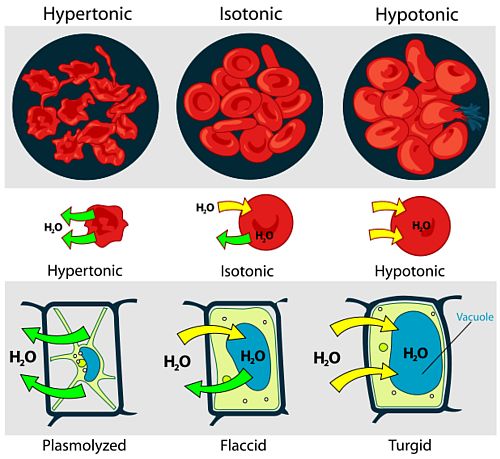
geçişme, olarak da bilinir, su ya da başka bir çözücünün, yalnızca çözücü moleküllerini geçirip çözünmüş maddelerin geçişini engelleyen yan geçirgen bir zardan yayınım yoluyla geçmesi.
Sponsorlu Bağlantılar
Bazı araştırmacılar, idrar kesesi gibi tam geçirgen zarlardan su ve çözünmüş maddelerin ters yöndeki geçişini incelemiş, ama doyurucu sonuçlara varamamışlardı. Biyolojide büyük önem taşıyan bu süreci 1877de ilk kez aynntılı biçimde inceleyen Alman bitki fizyolojisti Wilhelm Pfeffer olmuş, osmoz terimini ise ilk kez 1854te İngiliz kimyacı Thomas Graham kullanmıştır.
Eğer bir çözelti ile katışıksız bir çözücü, çözünmüş maddeleri geçirmeyip yalnızca çözücüyü geçiren bir zarla birbirinden ayrılırsa, zarın öbür yanma geçen çözücü, çözeltinin derişikliğini azaltacaktır.
Çözeltiye, geçişme basıncı denen belirli bir basınç uygulanarak bu süreç engellenebilir. Hollanda asıllı Alman kimyacı Jacobus Henricus vant Hoff, 1886da, çözünmüş maddelerin çok seyreltik olması ve çözeltiye uyguladığı kısmi buhar basıncının, Henry yasası uyarınca, çözeltideki derişikliğiyle orantılı olması durumunda, geçişme basıncının derişikliğe ve sıcaklığa bağlı olarak değişeceğini ortaya koydu. Çözünmüş maddeyi, aynı hacmi kaplayan bir gazla aynı yasanın çerçevesine yerleştiren bu bağıntı, seyreltik çözeltilerdeki çözünmüş maddelerin molekül ağırlıklarını, çözücünün donma ve kaynama noktalan ya da buhar basıncı üzerindeki etkilerine dayanarak belirleme olanağı veren denklemlerin geliştirilmesine ortam hazırladı.
kaynak: Ana Britannica
Son düzenleyen Safi; 23 Şubat 2017 02:36

 Osmoz (Geçişme). Osmotik Basınç
Osmoz (Geçişme). Osmotik Basınç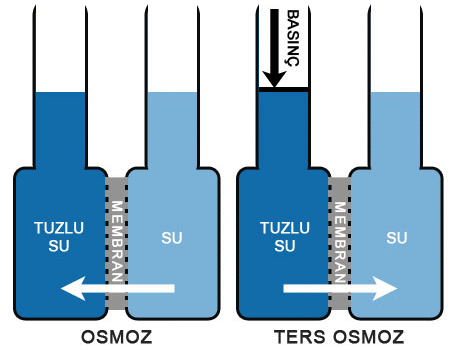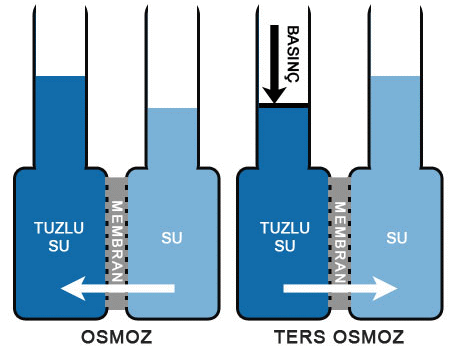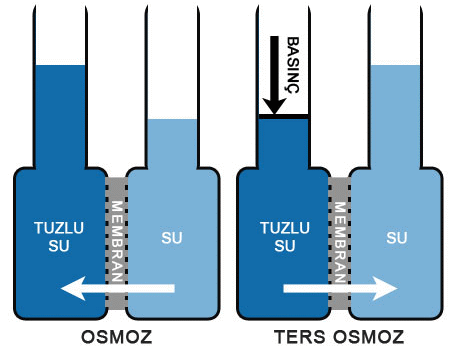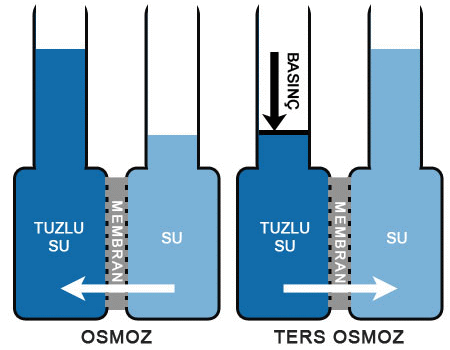
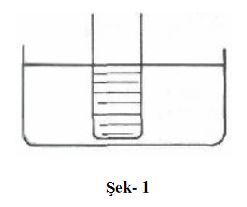
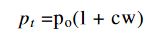
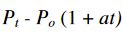 basıncı, sıcaklığına bağlıdır.
basıncı, sıcaklığına bağlıdır.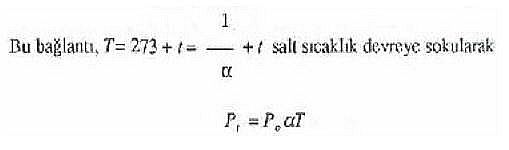
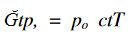 bağlantısı kurulur: osmotik basınç, salt sıcaklıkla orantılıdır.
bağlantısı kurulur: osmotik basınç, salt sıcaklıkla orantılıdır.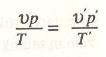 olur.
olur.