METALLER VE ÖZELLİKLERİ
Günümüzde elementlerin sınıflandırılması temelde iletkenliklerine dayandırılmaktadır. Buna göre metaller ısı ve elektriği iyi iletirler, ametaller ise normal koşullarda iletken değildirler. Bir kısım elementler ise ısı ve elektriği bir miktar iletirler, ancak iletkenlikleri metallerin tersine sıcaklıkla artar. Bunlara yarı
metaller denir.
Metaller, metalik bağlı kristaller oluştururlar, koordinasyon sayılan yüksektir. (8 veya 12) Metal atomlarının en dış elektronları (değerlik elektronları) ametallerde olduğu gibi Kovalent bağ yapmak üzere çiftlenmezler. Katı haldeki bir metalde atomlar birbirine çok yakın olduğundan, bir atomun değerlik elektronları diğer atomların etki alanına girer.
Yarı metallerde dolu ve boş molekül bantları arasındaki enerji farkı oldukça küçüktür ve bir miktar iletkenlik vardır. Bu iletkenlik elektronların enerjisini artıran bir dış etki ile (ışık veya ısı) artırılabilir. Bunlar tabaka yapısında veya uzun zincirler halinde büyük moleküller oluştururlar. Koordinasyon sayıları oldukça küçüktür (4 veya 4 ten az). Metallerde ise molekül bantları kısmen dolu olup elektronların serbestçe hareketi sonucu iletkenlik fazladır.
Birkaçı dışında oda sıcaklığında hepsi katı halde bulunan metaller kristal denilen belirli geometrik şekiller oluştururlar.
KRİSTAL YAPI
Kristaller, düzlem yüzeylerin kristale özgü belirli açılar altında birleşmesiyle oluşur. Kristal katılar üzerinde yapılan çalışmalar kristal örgüyü oluşturan atom, molekül veya iyonların uzayda bütün örgü boyunca düzenli olarak tekrarlandığını göstermektedir. Bir kristal örgünün, kristalin bütün özelliklerini taşıyan en küçük parçasına birim hücre denir.
Birim hücrede atom sayısı ve koordinasyon sayısının çeşitli şekillerde bulunması ile çeşitli türlerde kristal yapılar oluşur. Bunlara örnek olarak Basit Küp, Hacim Merkezli Küp, Yüzey Merkezli Küp gösterilebilir.
Metal kristallerinde tekrarlanan birimler artı yüklü iyonlardır. Değerlik elektronları yalnız kendi atom çekirdeklerinin değil bütün komşu çekirdeklerinin etkisi altında bulunur. Her yöne doğru hareket edebilir. Bu nedenle metal kristallerinin bir elektron denizi içinde düzenli bir şekilde yerleşmiş artı yüklü iyonlardan oluştuğu söylenebilir. Kolaylıkla akabilen elektron denizi metale elektriksel iletkenlik kazandırır. Artı yüklü iyonlar elektriksel yük dengesini bozmadan yer değiştirebildiklerinden metaller tel ve levha haline getirilebilirler ve yumuşaktırlar. Mekanik bir kuvvetin etkisi altında yeni metalik bağlar oluşacağından metalin özellikleri değişmez.
Metallerin birçoğunda iyon-elektron denizi etkileşiminden başka artı yüklü iyonlar arasında kovalent bağlar (elektron ortaklaşması) da oluşur. Böyle metaller serttirler. Demir ve tungsten buna örnek olarak verilebilir.
MANYETİK ÖZELLİK
Maddeler manyetik özelliklerine göre üç gruba ayrılabilir. Genellikle manyetik alandan kaçan, dış manyetik alan tarafından itilen maddelere diyamanyetik, manyetik alana doğru çekilen maddelere de paramanyetik maddeler denir. Ayrıca demir, kobalt, nikel ve bunların alaşımları, Fe3O4 bazı bakır-mangan alaşımları gibi maddeler paramanyetik maddelerden en az bin kez daha fazla bir kuvvetle manyetik alana çekilirler. Bu tür maddelere de ferromanyetik maddeler denir.
Manyetik özellik, elektronların kendi ekseni çevresindeki hareketleri (spinleri) ile ilişkilidir. Elektronları eşleşmiş olan atomlar manyetik özellik göstermezler. Çünkü bunlarda eşlenmiş elektronlar birbirine karşıt yönde döneceğinden manyetik alanları birbirini yok eder. Sonuçta madde diyamanyetik özellikte olur.
Eşlenmemiş bir tek elektronu bulunan maddeler zayıf bir manyetik etki gösterirler. Eşlenmemiş elektron sayısı arttıkça manyetik özellik artar. Bir elementin ferromanyetik olması için aşağıdaki koşulları sağlaması gerekir.
- Tam dolu olmayan d ve f yörüngeçlerine sahip olmalıdır.
- Kristal örgüde atomlar birbirine çok yakın olmamalıdır. Aksi durumda, birbirine komşu atomlardaki tek elektronlar etkileşerek zıt yönde dönme kazanır ve böylece elektron eşlenmesi yaparak etkilerini yok ederler.
- Atomlar kristalde birbirinden çok uzakta olmamalıdır. Aksi halde bir atomdaki eşlenmemiş elektronlar komşu atomlardaki elektronlarla etkileşip aynı bir doğrultuda düzenlenemezler.
METALLERİN AKTİFLİK SIRASI
Bilindiği gibi metaller elektron vererek bileşik yaparlar, yani elektropozitiftirler. Ancak, elektron verme eğilimleri birbirinden farklıdır. Metaller elektron verme yatkınlıklarına yani yükseltgenme potansiyellerinin azalışına göre sıralanırsa aktiflik sırası elde edilir. Metallerin en aktifi potasyum, en az aktifi ise altındır. Genellikle bir metal, sırada kendisinden aşağıda bulunan herhangi bir metali bileşiklerinden açığa çıkarır. Metallerin oksijen, kükürt ve halojenlerle tepkimeye girme eğilimi aşağıya doğru inildikçe azalır. Aynı şekilde bileşiklerin oluşması ve kararlılığı da aşağıya inildikçe azalır.
METALLERİN FİZİKSEL ÖZELLİKLERİ
- Metallerin fiziksel özelliklerinden en önemlileri şu şekilde sıralanabilirler.
- Isıyı ve elektriği iyi iletirler.
- Dövülüp şekil verilebilir, tel ve levha haline getirilebilirler.
- Işığı geçirmezler fakat metalik parlaklık gösterirler.
- Yoğunlukları fazladır.
- Oda sıcaklığında çoğu katıdır. (civa sıvıdır)
- Bir kısmı paramanyetik özelliktedir.
- Vurma ve çekmeye dayanıklıdırlar.
METALLERİN KİMYASAL ÖZELLİKLERİ
- Metallerin en önemli kimyasal özellikleri şu şekilde sıralanabilir.
- Metal atomlarının en dış yörüngelerinde az sayıda (en çok 4) elektron bulunur ve bunlar serbest elektronlardır.
- iyonlaşma potansiyelleri düşüktür, yani değerlik elektronlarını kolaylıkla verirler.
- İyi indirgendirler.
- Hidroksitleri bazik veya amfoterik özellik gösterir.
- Elektropozitiftirler, yani oksitlenme sayıları pozitiftir.
- Metal reaksiyonları
oxijen ile 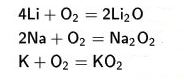
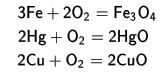 nitrojen ile
nitrojen ile 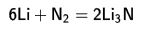
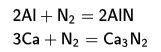 hidrojen ile
hidrojen ile 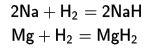 acid ile
acid ile 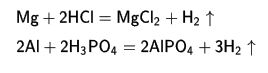

METALLERİN SINIFLANDIRILMASI
Metalleri sınıflandırmak için, periyodik çizelgeyi kullanmak yararlı olacaktır. Buna göre metaller; geçiş öncesi metalleri, geçiş metalleri, B metalleri ve lantanid ve aktinitler olmak üzere dört ana sınıfa ayrılabliir.
GEÇİŞ ÖNCESİ METALLERİ
Grup IA ile grup IIA elementleriyle grup IIIA elementlerinden alüminyum, skandiyum ve yitriyum bu sınıfa girer. Bu metaller en dış yörüngeçlerindeki s elektronlarıyla da belirlenir. Bu nedenle onlara s bloğu elementleri de denir. Bu metaller en dış s elektronlarını kolaylıkla vererek soy gaz elektron dizilişinde olan iyonlarını oluşturur.
GEÇİŞ METALLERİ
Grup IIA ile grup IB arasında yer alan elementlerden oluşur. Ancak skandiyum, yitriyum ve lantanyumda geçiş metali özelliği tam olarak belirgin olmadığı gibi grup IB elementlerinde B metali özelliği de görülür. Bu metaller birçok yönleriyle aktinitlere benzerler. Bunlarda d yörüngeçleri bileşik yapmada önemli rol oynar. Bu nedenle bunlara genellikle d bloku elementleri de denir.
B METALLERİ
Bu sınıf grup IB elementlerinden ametallere kadar olan elementleri kapsar. Bu metaller ametallerle metaller arasında bir geçiş yaparlar. Bunların çoğu metallere özgü sık istiflenmiş örgü yapısı göstermez. Koordinasyon sayılan 2,4 ve en çok 6 olur.
LANTANİD VE AKTİNİDLER
Lantanitler içteki 4f, aktinitler ise 5f yörüngeçlerinin doldurulmasıyla karakterize edilir. Bu nedenle bunlara f bloğu elementleri de denir. Lantanidlerde +3 ve daha fazla değerlikli iyonlar kimyasal tepkimelere karşı ilgisiz olarak kabul edilir. Aktinitlerde ise elektronlar kimyasal bağ yapmaya daha yatkındır.
METALLERİN DOĞADA BULUNUŞU
Hidrojenden daha az aktif olan metaller doğada çoğunlukla serbest halde bulunurlar. Bakır, gümüş gibi bazı metaller ise hem serbest halde hem de bileşikleri halinde bulunabilir. Beklenildiği gibi suda az çözünen metal bileşikleri yer kabuğunda, suda çok çözünenler ise deniz suyunda veya iç denizlerin buharlaşmasıyla oluşan geniş tuz yataklarında bulunur.
Yeryüzündeki metal ve metal bileşiklerinden oluşan, içlerindeki metal ekonomik olarak elde edilebilen doğal maddelere maden veya maden cevheri denir. Serbest halde bulunan metallerin dışında maden cevherleri, metalin bağlı bulunduğu ametal veya asit köküne göre isimlendirilir.
Maden cevherleri aşağıdaki şekilde sınıflandırılabilir. - Basit cevherler: Altın, gümüş, platin, bakır, cıva, arsenik, antimon, bizmut cevherleri gibi.
- Oksit cevherleri: Demir, alüminyum, mangan, kalay oksit cevherleri gibi.
- Sülfür cevherleri: Çinko, kadmiyum, cıva, bakır, kurşun, nikel, kobalt, gümüş, arsenik, antimon sülfür cevherleri gibi.
- Karbonat cevherleri: Demir, kurşun, çinko, bakır, kalsiyum, baryum, stronsiyum, magnezyum karbonat cevherleri gibi.
- Halojenür cevherleri: Potasyum, magnezyum, kalsiyum, gümüş halojenür cevherleri gibi.
- Sülfat cevherleri: Kalsiyum, baryum, kurşun sülfat cevherleri gibi.
- Silikatlar: Silikatların çoğu, içlerindeki metallerin elde edilmesindeki güçlük nedeniyle, çok önemli değildir. Berilyum, çinko ve nikel silikat cevherleri en önemlileridir.
Yer yüzünün geniş bir bölümünü kaplayan okyanuslar en büyük maden yatağı olarak bilinmektedir, örneğin bir ton deniz suyunda yaklaşık 28 kg. sofra tuzu, 1.3 kg. magnezyum, 0.9 kg, kükürt, 0.4 kg. potasyum, 0.6 kg. brom ve az miktarda stronsiyum, bor, flor, iyot, demir, bakır, kurşun, çinko, uranyum, gümüş, altın ve hatta radyum gibi radyoaktif metaller bulunmaktadır.
Deniz suyundan elde edilen ilk mineral şüphesiz sofra tuzudur. Deniz suyunun kabarma zamanında (met-cezir olayı) önü kesilerek buharlaşmaya bırakılırsa tuz, diğer katı maddelerle birlikte geride kalır. Bu tuz aşamalı (fraksiyonlu) kristallendirme ile saflandırılabilir ve birçok maddeler için, özellikle alkali ve klor endüstrisinde, ham madde olarak kullanılır. Deniz suyundan bugün magnezyum ve brom da elde edilmektedir. Bunun yanı sıra altın, gümüş, potasyum ve özellikle uranyum elde edilmesi de olasıdır. Ancak bu elementlerin deniz suyundan elde edilmesi ekonomik olmadığından bazı dolaylı yöntemler uygulanır. Okyanuslar büyük çapta uranyum kaynağıdır. Uranyum ise bilindiği gibi kömür ve petrol kaynaklarının tükenmesinden sonra en önemli enerji kaynaklarından birisi olacaktır.
-derlemedir-