1A Grubu Elementlerinin Genel Özellikleri
1A grubu elementleri hidrojen (H), lityum (Li); sodyum (Na), potasyum (K), rubidyum (Rb), sezyum (Cs), ve fransiyum elementlerinden oluşur. Grup elementlerinden hidrojen ametal, diğerleri metaldir. Bundan dolayı hidrojen genellikle grubun dışında değerlendirilir. Grup elementlerinin en dış enerji düzeylerinde 1 elektron vardır. Bu da bileşiklerin de bu elektronları kolaylıkla vererek soy gaz elektron düzeyine ulaşıp iyonik yapılı bileşikler oluşturmalarına neden olur. Aynı periyotta atom yarıçapı en büyük olan elementlerdir. Grup içinde elementlerin atom yarıçapları yukarıdan inildikçe artar. İyonlaşma enerjileri ise yukarıdan inildikçe azalır. Bunun nedeni atom yarıçapı arttıkça iyonlaşma enerjisinin azalmasıdır.
Alkali Metaller
Periyodik cetvelin birinci grubunda lityum (Li), sodyum (Na), potasyum (K), rubidyum (Rb), sezyum (Cs) ve fransiyum (Fr) elementleri bulunur. Bu grup elementlerinin hidroksitleri kuvvetli baz özelliği gösterdiğinden bazik anlamına gelen alkali metaller adıyla anılır.
Genel Özellikleri
- Bu grup elementlerinin son yörüngelerinde bir elektron vardır.
- Alkali metaller , bir elektronunu kolaylıkla vererek + 1 değerlikli olurlar ve soy gaz elektron yapısına ulaşırlar.
- Her periyot atom yarıçapı, en büyük ve birinci iyonlaşma enerjisi en küçük ikinci iyonlaşma enerjisi en büyük olan grup 1A elementleriyle başlar.
- Grup içinde elementlerin atom yarıçapları yukarıdan aşağıya inildikçe artar. Bunun nedeni periyot numarası arttıkça yörünge sayısının da artmasıdır.
- Grupta, yukarıdan aşağıya inildikçe atom numarası ve çekirdek yükü artar. İyonlaşma enerjisi ise yukarıdan aşağıya inildikçe azalır. Bunun nedeni çekirdek yükünün artması, atom yarıçapının artması yanında daha az etkili olmasıdır.
- Grupta, yukarıdan aşağıya inildikçe elektron verme yatkınlığı arttığı için metallerin aktifliği de artar.
- Alkali metallerin tuzları, suda diğer bütün metallerin tuzlarından daha kolay çözünür. Kuvvetli asitlerin alkali metal tuzlarının çözünürlüğü yukarıdan aşağıya inildikçe azalırken zayıf asitlerin alkali metal tuzlarının çözünürlüğü artar.
Fiziksel Özellikleri
- Metalik özellikleri gereği parlaktır. Diğer metallerin aksine, bıçakla kesilebilecek kadar yumuşaktır. Yeni kesildiklerinde gümüş rengindedir.
- Isı ve elektriği çok iyi iletir.
- Diğer metallerin aksine, yoğunlukları ve erime noktalan oldukça düşüktür. Lityumun, sodyumun ve potasyumun yoğunluklan ilginç bir şekilde sudan daha küçüktür.
- Sezyumun erime noktası o kadar düşüktür ki sezyum sıcak günlerde sıvı hâlde bulunabilir.
- Bütün alkali metaller, cıvada ısı açığa çıkararak çözünür ve alaşım (amalgam) oluşturur.
Kimyasal Özellikleri
Hepsi çok aktif olup tabiatta serbest hâlde bulunmaz. Havadan kolaylıkla etkilenerek oksit oluşması nedeniyle yüzeyleri matlaşır. Rubidyum ve sezyum ise havada yanar. Bu nedenle Li, Na ve K parafinde veya gaz yağında, Rb ve Cs vakumda saklanır.
Alkali metaller su ile tepkimeye girerek hidrojen gazı açığa çıkarır.
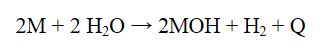
Tepkime ekzotermik olup çoğu zaman yanma şeklinde gerçekleşir. Çünkü tepkimede açığa çıkan ısı, oluşan hidrojenin alev alması için yeterlidir.
Grup elementlerinin elektronegatiflikleri, halojenler, oksijen, kükürt, fosfor ve hidrojen gibi ametallerinkinden daha düşük olduğu için bu elementlerle kolaylıkla tepkime verir.
kaynak: Kimya Teknolojisi