Tampon çözeltiler
- Kimyada belli pH'larda çözelti hazırlamak ve bunu uzun süre kullanmak çok önemlidir. Ancak bu çözeltilerin saklanması hazırlanmasından daha zordur.
- Bu tür çözeltiler HCl gibi kuvvetli asitlerden Hveya NaOH gibi kuvvetli bazlardan hazırlandığında havadaki CO2 ten veya bulundukları cam kaplardan kolaylıkla etkilenerek pH'ları değişir.
- Örneğin çözeltinin hava ile temas etmesiy ile havadaki karbondioksiti soğurur ve pH düşer. Bu çözelti cam kaplarda saklandığında, camın eser halde de olsa çözünmesi pH yükselmesine neden olur.
- Az miktarda asit veya baz eklenmesinden bile önemli ölçüde etkilenmeyen çözeltilere tampon çözeltiler denir.
- Tampon çözeltiler, zayıf bir asit veya baz ile bunun tuzundan hazırlanır.
Tampon çözelti - Tampon çözelti: Konjuge asit-baz çiftinin bulunduğu ve pH değişmelerine karşı direnç gösteren çözeltilere denir.
- Zayıf bir asit-kuvvetli bir baz veya zayıf bir baz kuvvetli bir asit H titrasyonlarında (karışımlarında) konjuge asit/baz çifti içeren tampon çözelti oluşur
- Zayıf bir asit olan asetik asit ve sodyum asetat çözeltileriyle hazırlanmış bir tampon çözelti düşünelim. Buradaki denge ve H denge bağıntısı aşağıdaki gibi yazılabilir.
- Bu bağıntıda da [H+] yalnız bırakırsak yandaki bağıntı elde edilir.
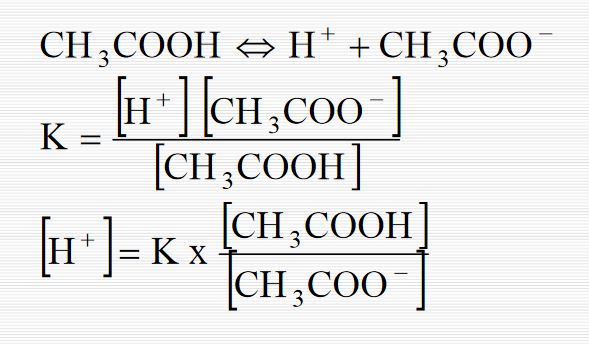
- Bu bağıntı asetik asit çözeltisinde H[H+] derişiminin K sabitine ve ayrışmamış asetik asit derişiminin, çözeltideki toplam asetat iyonu değişimine bağlı olduğunu gösterir.
- Başlangıçtaki asetik asit ve sodyum asetat derişimlerinin birbirine eşit olduğu (Mesela her ikisinin de 0,1 olduğu) özel bir durumu düşünelim.
- Bu durumda bağıntıdaki H[CH3COOH]/[CH3COO-] oranı "1" e eşit olacağından [H+] derişimi doğrudan [H+] = K olur.
- Dolayısıyla [CH3COOH] / [CH3COO-] foranı 1'den çok farklı olmadığı müddetçe çözeltinin pH'ında önemli Hbir değişiklik olmaz.
- Çünkü böyle bir çözeltiye az miktarda asit eklenirse, denge sol yöne kayar ve fazla H miktardaki asetat iyonları ile hemen asetik asit molekülünü meydana getirir.
- Bir başka deyişle eklenen asitin etkisi azalır.
- Öte yandan aynı çözeltiye hidroksit iyonları eklenirse bu ortamdaki hidrojen iyonlarını nötürleştirir.
- Ancak denge sağ yana kayar ve aşırı miktarda asetik asit molekülleri hemen H iyonlaşarak tekrar hidrojen iyonları meydana getirir.

- Burada şüphesiz sodyum iyonunun pH'a bir etkisi yoktur.
- Asetat iyonu ise asetik asitin bir konjuge bazı olduğundan, sulu çözeltide yandaki şekilde bir dengeye neden olur.
- Bu dengedeki OH- derişiminin hesaplanabilmesi için Kb değerinin bilinmesi gerekir.
- Oysa tablolarda yalnız asetik asitin iyonlaşmasına ait Ka değeri verilmektedir.
- Ka ve Ksu değerleri ile Kb hesaplanır.
- Ksu = [H+] [OH-] = 1,0 x10-14
- Eğer Ksu eşitliği Ka eşitliğine bölünürse Kb eşitliği elde edilir.
- O halde genel olarak şu eşitlik yazılabilir. Ka x Kb = Ksu
- Problemin ikinci kısmında izlenecek yol öncekinin aynıdır.
Tampon çözeltiler - Bilinen tamponların birçokları zayıf asit veya bazların konjuge tuzları ile karıştırılmasıyla elde edilirler.
- Konjuge tampon çözeltilerde pH, Ka değeri ile asit derişiminin konjuge bazının derişimine oranına eşittir.
- Örneğin aşağıdaki bütün tamponların pH ları 4,92 dir.
- 0,20 M HAc/0,3 M Ac- 0,10 M JHAc/0,15 M Ac- 0,020 M HAc /0,03 M Ac- vs.
- Tamponlanmış çözeltinin pH ının tamponun bileşenlerinden bağımsızdır, yalnız oranı önemlidir
Tampon derişiminin etkisi
- Eklenecek asit veya bazın, tampon tarafından absorplanması sonucu, pH da görülecek değişme tampon bileşenlerinin derişimine bağlıdır.
- Örneğin 0,20 M HAc / 0,3 M Ac- şeklinde hazırlanmış ve pH'ı 4.92 olan tampon çözeltiye 10 ml 10 M HCl eklediğimizde pH 4,56 olurdu ki 0,36 birimlik değişiklik çoğu kez kabul edilebilir sınırlar içinde olabilir.
- Ancak biyokimyasal bir ortam söz konusu olduğunda bu fark önemli olabilir.
- Bu durumda yeni bir tampon çözelti hazırlanması gerekir.
- Örneğin yukarıdaki tampon çözelti 0,2 M HAc/0,3 M Ac- şeklinde değilde 0,8 M HAc/1,2 M Ac- şeklinde nazırlansaydı ve yine 10 ml 10 M HCl eklenseydi, HCl eklenmeden önceki pH = 4,917 iken, HCl eklendikten sonraki pH = 4,827 olurdu
- Görüldüğü gibi bu durumda pH daki değişme ancak 0.089 kadardır ki 0,36 farka göre oldukça düşüktür.


- Eklenecek asit veya bazın, tampon ^tarafından absorplanması sonucu, pH da görülecek değişme tampon bileşenlerinin Hderişimine bağlıdır.
- Örneğin 0,20 M HAc / 0,3 M Ac- şeklinde hazırlanmış ve pH'ı 4.92 olan tampon çözeltive 10 ml 10 M HCl eklediğimizde pH 4,56 olurdu ki 0,36 birimlik değişiklik çoğu Hkez kabul edilebilir sınırlar içinde olabilir.
- Ancak biyokimyasal bir ortam söz konusu olduğunda bu fark önemli olabilir.
ÖRNEK 2:
1 litre saf suya 1 ml 0,1 M HCl eklenmesiyle pH da görülen değişim ile 0,2 M HAc ve 0,3 M NaAc içeren tamponlanmış yine 1 litre çözeltiye aynı miktarda HCl eklenmesiyle pH da görülecek değişimi karşılaştırınız.
- Saf suyun ilk pH'sının 7 olacağı doğaldır. 1 ml 0,1 M HCl'in 1000 mlfye eklenmesi demek, yaklaşık 1000 kez seyreltilmesi demektir.
- Dolayısıyla hidrojen iyonu derişimi 0,00001 M veya pH = 4 olur. Yani pH 7'den 4'e iner.
- Asetik asit tamponunda HCl eklenmeden önceki pH = 4,9160 dir.
- HCl eklendikten HAc dengesinde, Le Chatelier ilkesine göre ortalama eklenen H+ çeşitliğinin sola kaymasına yani eklenen H+ Hkadar HAc oluşumuna neden olacaktır.
- HCl, zayıf bir baz (Ac-) içeren çözeltiye eklendiğine göre, protonun büyük bir kısmı çtüketilecek ve denge tekrar kurulacaktır.
- 1 ml HCl, 10-4 M H+ verdiğinden ve bu da 1,0x10-4 M Ac- ile tepkimeye girip aynı çmiktarda HAc oluşumuna neden çolacağından, pH=4,9156 olur.
Görüldüğü gibi aynı miktarda HCl saf suya eklendiğinde pH da 3 birimlik bir azalma olurken (pH 7'den pH 4'e) tamponlanmış çözeltide ancak 0,0004 birimlik bir azalmaya neden olmaktadır ki buna ölçülemeyecek Hkadar küçük bir değer denilebilir.