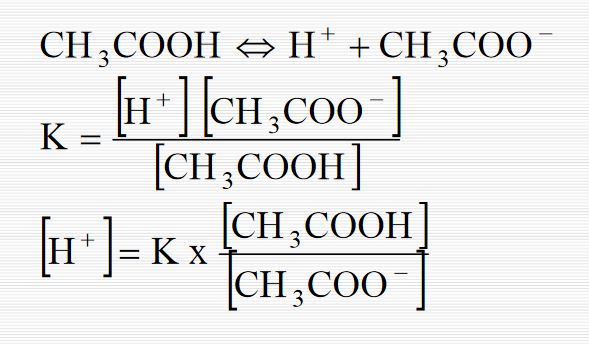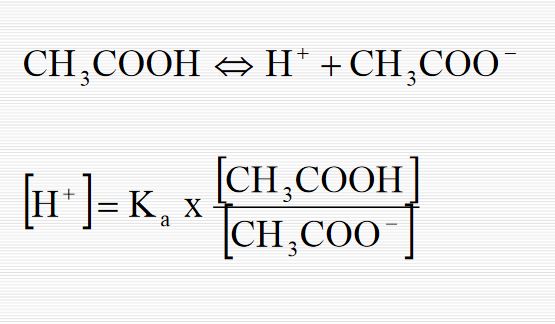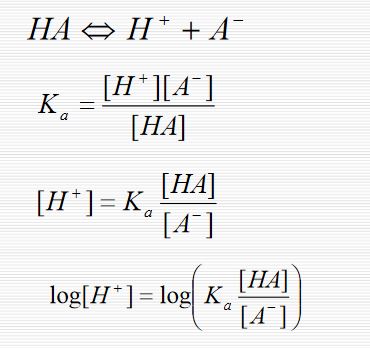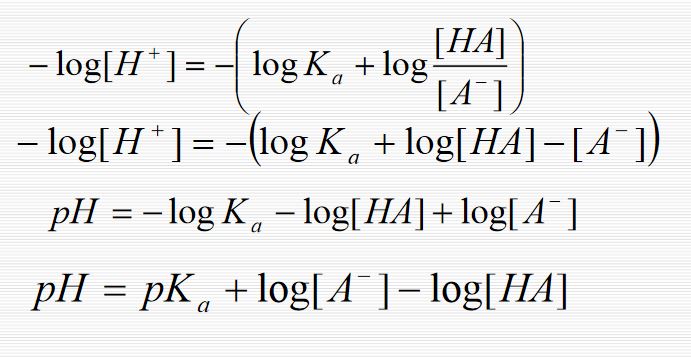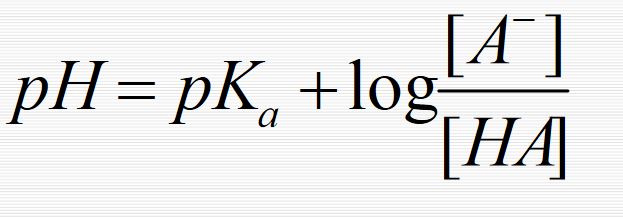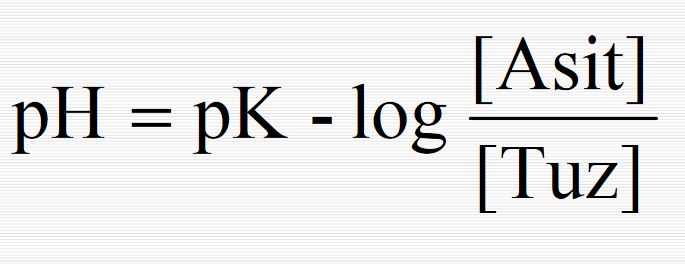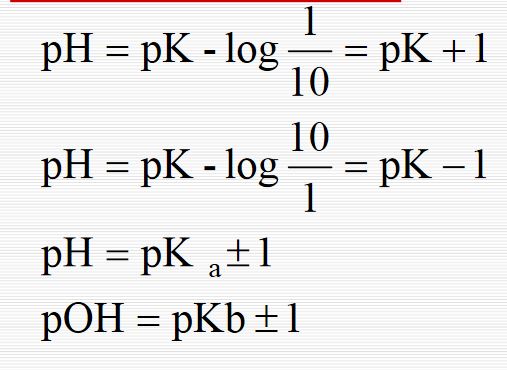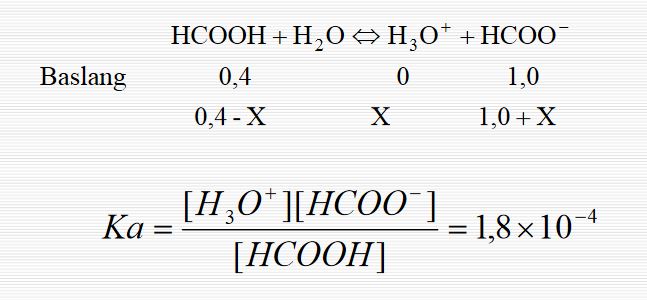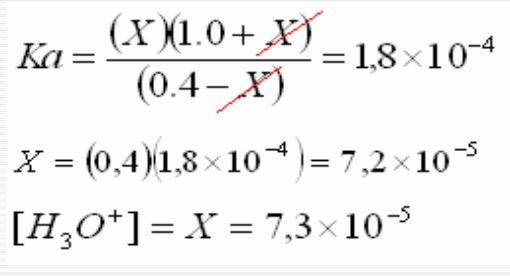TAMPON ÇÖZELTİLER

H+ + AcO- → HOAc OH- + AcOH → H2O + AcO-
Sponsorlu Bağlantılar
Benzer şekilde amonyak-amonyum klorür tamponu için
H+ + NH3 → NH4+ OH- + NH4+ → H2O + NH3 tepkimeleri yazılabilir.
Bununla beraber, bir poliprotik asidin çeşitli nötralleşme derecelerine malik tuzlarından ( örneğin NaH2PO4 ve Na2HPO4 karışımı ) yararlanılabildiği gibi zayıf bir asitle başka bir asidin tuzundan ibaret sistemlerden de ( örneğin sitrik asit ve sodyum fosfat gibi ) yararlanılır.
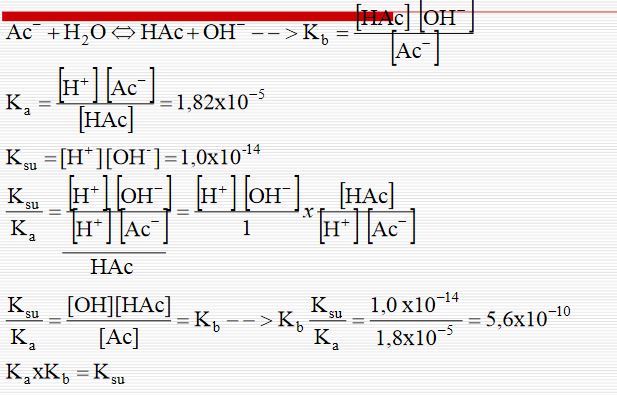
Zayıf bir asitle ( HA ) tuzunun ( A- ) tampon etkisi, hidrojen iyonlarının zayıf asidin A- bazı ile birleşerek iyonlaşmış HA moleküllerini vermesiyle açıklanır:
A- + H3O+ H2O + HA Oysaki OH- iyonları,
OH- + HA H2O + A- denklemine göre yer değiştirmiş olurlar.
Tampon, zayıf bir B bazı ile tuzu karışımından ibaret ise dengeler şöyledir :
H3O+ + B H2O + BH+ OH- + BH+ B + H2O
Örneğin zayıf bir asitle ( HA ) bunun kuvvetli biz bazla verdiği B+A- tuzu karışımından ibaret tampon sistemi düşünelim. Asidin protolizi şöyledir:
HA + H2O H3O+ + A- Kütlenin etkisi kanunu uygulandığında ,
[H3O+] [A-] [HA] ka = ; [H3O+] = ka [HA] [A-]
Buradan ; [HA] - log [H3O+] = - log ka - log [A-] veya, [A-] pH = pka + log (1.1) [HA] bulunur.
Oysaki [A-] = [Tuz] ve [HA] = [Asit] olduğundan; [Tuz] pH = pka + log (1.2) [Asit] olur ve Henderson denklemi adını taşır. Bu denklem 10 > pH > 4 arasında seyreltik çözeltilere uygulanır.
TAMPON GÜCÜ
Bir tampon çözeltiye dB ekivalan / litre kadar kuvvetli bazdan veta kuvvetli asitten ilâve edildiğinde ph değişmesi dpH ise, dB ß = dpH diferensiyel oranına tampon gücü veya değeri denir. O halde tampon gücü, pH nin birim kadar değişmesi için ilâvesi gereken baz yahut asit miktarıdır, dB ye karşı pH değişmesi ne kadar az is ise tampon gücü de o kadar büyük, yani pH o kadar sabittir. Bir tampon sisteminin tampon gücü, tuz konsantrasyonunun asit konsantrasyonuna oranı 10 ile 1/10 arasında olduğu zaman en elverişlidir. Bu ise pH = pka ±1e karşındır. O halde bir asit-baz tampon çözeltisinin yararlı pH tampon aralığı pka ±1 olarak alınabilir. Eğer deniş bir pH tampon aralığını kaplayacak tampon çözelti hazırlanmak istenirse, bir sıra zayıf asit seçmek gerekir ki bunların pka ları 2pH biriminden fazla fark etmemiş olsun. Buna göre maksimum tampon gücü ve belli pH li tampon çözelti hazırlamak için öyle bir asit seçmek gerekir ki asidin pka sı istenilen pH ye eşit veya mümkün mertebe yakın olsun. Bu halde, [Tuz] / [Asit] oranı 10 > pH > 4 halinde den hesaplanır. Tampon gücü bakımından önemli olan bir başka faktör de asit ve tuzun konsantrasyonlarıdır. Çözeltinin derişikliğinin fazlalığı oranında ve [Tuz] / [Asit] = 1/1 halinde tampon gücü fazladır. Aşağıdaki çizelgede bazı tampon sistemler verilmiştir.
Glisin Glisin hidroklorür
Ftalik asit Potasyum asit ftalat Asetik asit Sodyum asetat Monosodyum fosfat disodyum fosfat Borik asit boraks Boraks Sodyum hidroksid Disodyum fosfat trisodyum fosfat 1,0 - 3,7 1,2 - 3,8 3,7 - 5,6 5,8 - 8,0 6,8 - 9,2 9,2 - 11,0 11,0 - 12,0 Tampon Sistemler pH aralığı Tampon Karışım
KONU İLE İLGİLİ ÖRNEKLER
Örnek-1)
25oC da 0,1 M asetik asit ve 0,1 M sodyum asetat karışımının pH si ne kadardır? (ka =1,8 . 10-5)
Çözüm: 0,1
pH = 4,74 + log = 4,74
Örnek-2)
NaH2PO4 ve Na2HPO4 oranı ne olmalıdır ki tampon çözeltinin pH si 7,10 olsun? (pk1=7,21)
Çözüm: Denge reaksiyonu HPO4= + H+ H2PO4- olup HPO4= iyonu tuzu, H2PO4- de asidi verir. (1.2) den, [Na2HPO4] 7,10 = 7,21 + log [NaH2PO4] [Na2HPO4] = antilog ( - 0,11 ) = antilog 1,89 = 0,776 [NaH2PO4] bulunur.
Örnek-3)
pH si 4,0 olan bir tampon çözelti hazırlamak isteniyor. Maksimum tampon güçlü bir çözelti hazırlamak için a) aşağıda verilen asit ve tuzlarından hangisi kullanılmalıdır? b) Bu halde [Tuz] / [Asit] oranı ne olacaktır?
Asit ka
Asetik asit 1,8 . 10-5
Formik asit 2,1 . 10-4
Benzoik asit 6,5 . 10-5
Çözüm:
a) Yukarıdaki asitlerin pka ları 4,74 ; 3,7 ; ve 4,17 dir. Seçilecek asit öyle olmalıdır ki pka sı 4,0 e yakın olsun. O halde en uygunu benzoik asittir. b) (1.2) ye göre, [Tuz] 4,0 = 4,17 + log den [Tuz] / [Asit] oranı = 66/100 bulunur. [Asit]
Örnek-4)
Litrede 1) 0,000018 M HCl ; 2) 0,1 M asetik asit ve 0,1 M sodyum asetat içeren çözeltilerin pH lerini hesaplayınız. 3) Bu çözeltilerin birer litresine 0,000018 M NaOH ilâve edildiğinde yeni pH leri bulunuz. (ka= 1,8 . 10-5)
Çözüm:
1) pH = - log [H2O+] = - log 1,8 . 10-5 = 4,74 2) (1.2) den 0,1 pH = 4,74 + log = 4,74 0,1 3) Bu çözeltilerin bir litresine 0,000018 M NaOH ilâve edildiğinde HCl halinde tam nötrelleşme olduğundan, pH = 7,0 olur. Asetik asit ve tuzu karışımında ise, 4) 0,1 + 0,000018 pH = 4,74 + log ~ 4,74 0,1 0,000018 Görülüyor ki aynı miktar NaOH ilavesiyle HCl çözeltisi tampon olmadığından pH, 2,26 pH birimi kadar artmış ; oysaki ikinci halde tampon olduğundan pH, 0,001 pH biriminden daha az değişmiştir.
Örnek-5)
Bir çözeltide sodyum asetat ( NaAc ) ve asetik asidin ( HAc ) konsantrasyonları ne olmalıdır ki [H3O+] = 10-4 iyon g / litre olsun? ( ka = 1,85 .10-5)
Çözüm:
(1.2) den [NaAc] 4 = 4,74 + log [HAc] [NaAc] / [HAc] = 0,18 bulunur. O halde [Tuz] / [Asit] oranı 0,18 olduğunda [H3O+] = 10-4 dür. Şu oranlar alınabilir ;
[NaAc] = 0,18 M [HAc] = 1 M
[NaAc] = 0,0018 M [HAc] = 0,1 M
[NaAc] = 1,8 . 10-4 M [HAc] = 10 . 10-4 M
Bu sonuncu olmaz, çünkü çok seyreltiktir.
Örnek-6)
100cm3 0,6 M NH3 çözeltisi ve 150cm3 0,3 M NH3Cl çözeltisi karıştırılarak bir tampon çözelti hazırlanmıştır. a) Tamponun pHsı nedir? b) 0,001 mol asetik asit katılırsa pH ne olacaktır?
Çözüm:
a) Bu bazlı tampon içi OH- derişimi, NH3 için ka yı veren eşitlikten bulunabilir:
NH3 + H2O NH4+ + OH-
ka = [NH4+] [OH-] / [NH3]
[OH-] = ka [NH3] / [NH4+]
NH3 ve NH4+ derişimleri,
NH3 mol sayısı = 0,6 mol dm-3 x 0,1 dm3 = 0,06 mol
NH4+ mol sayısı = 0,3 mol dm-3 x 0,15 dm3 = 0,045 mol
[NH3] = 0,06 mol / 0,25 dm3 = 0,24 M
[NH4+] = 0,045 mol / 0,25 dm3 = 0,18 M
olduğuna göre
[OH-] = 1,8 x 10-5 x ( 0,24 / 0,18 ) = 2,4 x 10-5 M
ve
pOH = 4,62
pH = 0,38 bulunur.
b) Bu bazlı tamponda asit
H+ + NH3 → NH4+
tepkimesi ile nötralleşir. Katılan asidin derişimi
0,001 mol / 0,25 dm3 = 0,04 Mdır. O halde NH3 ve NH4+ yeni derişimleri,
[NH3] = 0,24 - 0,04 = 0,20 M
[NH4+] = 0,18 + 0,04 = 0,22 M olacaktır.
Yeni OH- ise
[OH-] = 1,8 x 10-5 x ( 0,20 / 0,22 ) = 1,6 x 10-5 M
ve yeni
pOH = 4,80
pH = 9,20 bulunur. Yani pH değişikliği yalnız 0,18 pH birimi kadardır.
SEYRELTME DEĞERİ ve TUZ ETKİSİ
Bir tampon çözelti eşit hacimde su ile seyreltildiğinde pH artmasına seyreltme değeri denir. ∆pH1/2 = ( pH )1/2 e ( pH )e Seyreltme değeri de tampon gücü kadar önemlidir, çünkü pratikte tampon değerinin seyreltme ile pH sinin değişmemesi istenir. Asidin değerliğinin büyüklüğü oranında seyreltme ile pH değişmesi o kadar fazladır. Bir tampon çözeltiye nötral tuz ilâve edilirse iyonik kuvvet artar, aktivite katsayısı azalır ve bunun sonucunda çözeltinin pH si küçülür. Tuz etkisi seyreltme etkisinin tersidir. Bir tampon sistemin pratik değeri,
1) Asit yahut baz ilâvesine;
2) Seyreltmeğe;
3) Nötral tuz ilâvesine karşı denemesi ile belli olur. Sıcaklık değişimi de tampon çözeltinin pH sini değiştirir.
KULLANIM ALANLARI
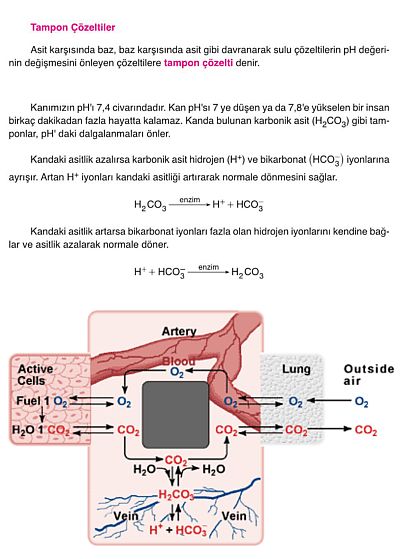
Tampon çözeltilerin kullanılma ve uygulanma alanları çok geniştir. Biyokimyasal tepkimelerin çoğunda, tepkimenin istenen yönde yürümesi için pHının sabit kalması gereklidir. Örneğin, kanda pH sabit tutmak için diğer sistemlerin yanısıra karbonik asit bikarbonat tamponu bulunur. Laboratuvarda, anorganik ve organik kimyasal tepkimeler, tepkimede harcanan veya oluşan asitlerin ve bazların yaz etkilerini azaltmak için, gerektiği zaman tamponlanmış çözeltilerde yapılır.BAKINIZ Çözeltiler
Son düzenleyen Safi; 3 Ocak 2017 18:34

 Tampon Çözeltiler
Tampon Çözeltiler