REDOKS
Elektron alış-verişi olan kimyasal tepkimelere redoks tepkimeleri denir.
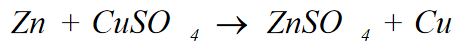
Denklemde nötral (yüksüz) durumda olan çinko (Zn), +2 değerlikli Cu iyonlarına 2 e- verir ve +2 değerliğe yükseltgenir.
Çinkonun verdiği 2e- u alan Cu+2 iyonları bu elektronlarla nötral duruma indirgenir.
Bu durum elementlerin e- alış-verişini gösteren yarı-iyonik denklemlerle ifade edilir:
Yarı-iyonik denklemler:
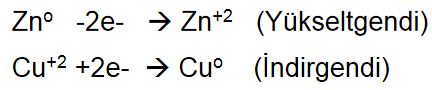
Redoks Tepkimelerinde Sıkça Kullanılan Kavramlar
İndirgenme: Bir reaksiyonda bir elementin e- alarak değerliğinin daha küçük bir sayıya düşmesi halidir. Örneğimizde bakır indirgenmiştir.
İndirgen: Karşısındaki element veya iyona e- vererek onun değerliğinin düşmesini sağlayan maddeye denir. Çinko indirgendir.
Yükseltgenme: Bir reaksiyonda bir element veya iyonun e- kaybederek değerliğinin artmasına denir. Örneğimizde çinko yükseltgenmiştir.
 Yükseltgen:
Yükseltgen: Bir element veya iyonun karşısındaki element veya iyondan e- alarak onun değerliğinin artmasını sağlayan maddeye denir.
Değerlik: Tepkimede tüm kimyasal bileşikleri iyonik karakterliymiş gibi kabul edip bu iyonların yük sayısına denir.
Bazı Elementlerin Değerlikleri
Oksijen: Peroksitleri (O2-2) ve süperoksitleri (O2'1) hariç tüm bileşiklerinde -2 değerliklidir.Peroksitlerinde -1, süperoksitlerinde -1/2 değerliklidir.
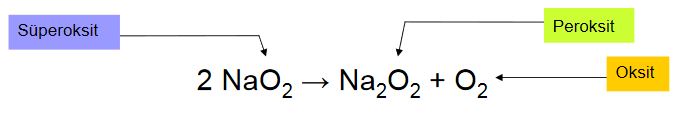
Süperoksitler, itfaiyecilere hızlı oksijen sağlayıcı olarak kullanılır.
Hidrojen: Hidrürleri hariç tüm bileşiklerinde +1 değerlikli olup hidrürlerinde -1 değerliklidir. Uzay Mekiği ana motoru hidrojen yakar ve neredeyse görünmez bir alev oluşturur.
Halojenler: Genellikle bileşiklerinde -1 değerliklidir. 1A grubu +1, 2A grubu +2 değerliklidir.
Redoks Tepkimelerinin Denkleştirilmesi
- Önce reaksiyona giren element ve bileşiklerin değerlikleri belirlenir.
- İndirgen ve yükseltgenler tespit edilir.
- İndirgenen ve yükseltgenenlere göre ayrı ayrı e- alış-verişini gösteren iyon denklemleri yazılır.
- Bu iyon denklemleri üzerinden e- dengesi kurulur ve bu dengenin bütün reaksiyona yansıtılabilmesi için gerekli koşul tespit edilir.
- Bu şarta göre toplu reaksiyonda kütle dengesi kurulur.
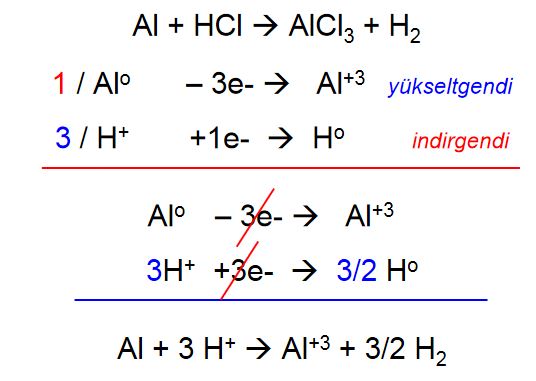
Koşul: 1 Alo a karşılık 3 H+ tepkimeye girmeli
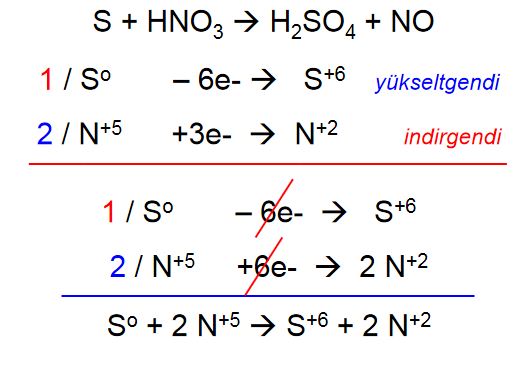
Koşul: 1 So e karşılık 2 N+5 tepkimeye girmeli.
Asidik ve Bazik Ortamda Redoks
Böyle ortamlarda redoks tepkimelerini denkleştirmek için;
- e- alış-verişine katılan elementler saptanır.
- e- dengesi sağlanır.
- Kütle dengesi sağlanır.
- Oksijen atomu eksik olan tarafa yeteri kadar H2O ilave edilir.
- Çözelti asidik ise hidrojen eksik olan tarafa yeteri kadar H+ ilave edilir.
- Çözelti bazik ise hidrojen eksik olan tarafa yeteri kadar OH- iyonu ilave edilir.
- Buna göre son denklemde tekrarlanan birimler varsa bunlar toplanır veya çıkarılır.
Asidik ortamda oluşan aşağıdaki tepkimenin katsayılarını denkleştiriniz.  Bazik ortamda oluşan aşağıdaki tepkimenin katsayılarını denkleştiriniz
Bazik ortamda oluşan aşağıdaki tepkimenin katsayılarını denkleştiriniz 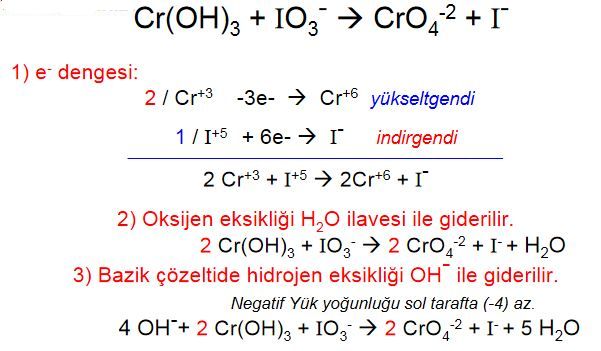 Asidik ortamda (HNO3 içinde)oluşan aşağıdaki tepkimenin katsayılarını denkleştiriniz.
Asidik ortamda (HNO3 içinde)oluşan aşağıdaki tepkimenin katsayılarını denkleştiriniz.  Bireysel Çalışma
Bireysel Çalışma 
