HİBRİTLESME
Kovalent baglar, orbitallerin örtüsmesi sonucunda gerçeklesirler. Orbitallerinde örtüsebilmesi için, örtüsmeye katilan orbitallerin birer elektron içermesi gerekmektedir.Her atom çiftlesmemis elektron sayisi kadar bag yapabilir. Iki veya daha fazla atom orbitallerini, birbirleri ile hibritlesmeye uygun simetriye getiriler. Böylelikle olusan yeni orbitallere hibrit orbitalleri denir. Hibirtlesmenin gerçeklesebilmesi için orbitallerin enerjileri birbirine yakin olmalidir.
(Sigma bağı) 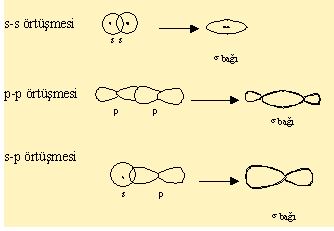
p (pi Bağı)
P orbitallerinin dikey olarak örtüsmesi ile olur.

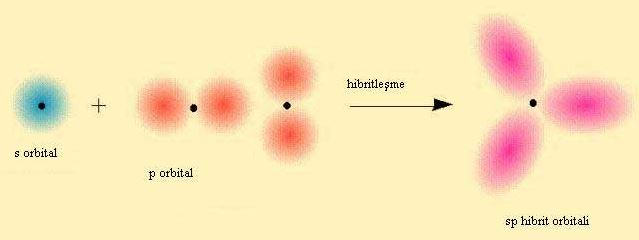
sp Hibritleşmesi
BeF2 örnegi verilerek sp hibritlesmesi açiklanabilir. Öncelikle atomlarin elektron dizilimleri yazilir.
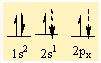
4Be 1s22s2
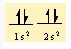
9F 1s22s2 2p5
Be' nin 2 tane bag yapabilmesi için 2 tane yari dolu orbitalinin olmasi gerekiyor . Bu nedenle 2s2 deki 2 elektronundan birini bir sonraki kabuga uyarir. Asagidaki gibi bag yapmaya hazir 2 tane yari dolu orbital olusturur.
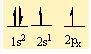
2 tane F atomunun 2pz deki elektronlari bu orbitallere yerleserek sp hibritlesmesi gerçeklestirirler.
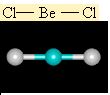
BeCl2 bag açilari 180° olan dogrusal sp hibriti yapar.
sp2 Hibritleşmesi
BH3 örnegi verilerek sp2 hibritlesmesi açiklanabilir. Öncelikle atomlarin elektron dizilimleri yazilir
5B 1s2 2s22p1

1H 1s1
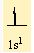
B nin 3 tane bag yapabilmesi için 3 tane yari dolu orbitalinin olmasi gerekiyor . Bu nedenle 2s2 deki 2 elektronundan birini bir sonraki kabuga uyarir. Asagidaki gibi bag yapmaya hazir 3 tane yari dolu orbital olusturur.
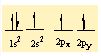
3 tane H atomunun da 1s1 deki elektronlari bu orbitallere yerleserek sp2 hibritlesmesini gerçeklestirirler.
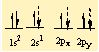
BH3 molekülü bag açilari 120° olan üçgen düzlem yapiya sahip sp2 hibritini olustururlar.
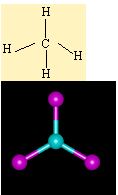
sp3 Hibritlesmesi
H atomunu elektron dagilimi
1H 1s1
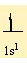
Karbon atomunun elektron dagilimi
6C 1s2 2s22p2 seklindedir.
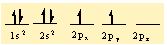
Bu durumda karbon atomunun bag yapabilecek 2 tane eslesmemis elektronu gözüküyor. Fakat 4 hidrojen atomu ile bag yapmasi bekleniyor. Bu durumda 2s2 deki iki elektrondan biri 2pz orbitaline uyarilir. Böylece karbon atomunu 4 tane bag yapabilecek yari dolu orbitali olusur.
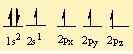
Böylelikle hidrojen atomu 4 tane yari dolu orbitale birer elektronunu vererek baglanma yapar.
C bir tane s ve 3 tane p orbitalini kullanarak bag açilari 109.5° olan tetrahedral sp3 hibritlesmesini gerçeklestirdi.
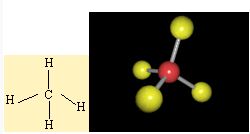
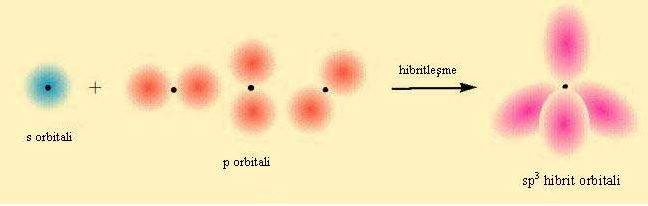
Bu örnekle karbon atomunun her zaman 4 bag yaptigini gördük. Diger bir gösteris sekliyle C degerlik bag elektron sayisi 4 tür (2s22p2) Buradaki4 tane elektron C atomu üzerine tek tek yerlestirilir. H atomunun degerlik elektron sayisi 1 (1s1) oldugundan ve 4 tane H atomu bulundugu için her bir H atomunun elektronu C atomunun elektronu ile eslesir.
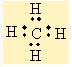
Ortaklanmamis elektronlarda sigma bagi gibi düsünülür.
Buna da örnek olarak NH3 (amonyak) verebiliriz.
7N 1s2 2s22p3
Normalde N (azot) H (hidrojen) ile 3 bag yapiyor gibi gözüküyor ama eger lewis yapisini çizecek olursak,
7N 1s2 2s22p3
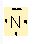
N'un 3 tane bag yapabilecek elektronu bulunmaktadir. Buda H atomunun 1 s1 orbitalindeki bir elektron ile 3 tane bag yapabilecegini gösteriyor.
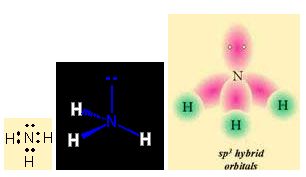
N üzerindeki baga katilmayan ortaklanmamis elektronlarda bag gibi sayilacagindan sp3 hibritlesmesi yapacaktir. Ortaklanmamis elektron çifti çekirdege daha yakindir. Bu yüzden s karakteri artar dolayisiyla bag açisi artar.
Bag elektronlari birbirini iter. Ortaklanmamis elektron çiftinin itme kuvveti bag elektronlarinkinden daha fazladir. Ortaklanmamis elektronlarin itme kuvveti fazla oldugu için beklenen 109.5° açidan sapma gösterir.
dsp3 Hibritlesmesi
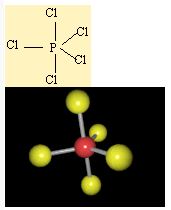
PCl5 örnegi verilerek dsp3 hibritlesmesi açiklanabilir. Öncelikle atomlarin elektron dizilimleri yazilir.
15P 1s2 2s22p63s23p3
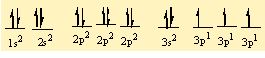
17 Cl 1s2 2s22p63s23p5
P' nin 5 tane bag yapabilmesi için 5 tane yari dolu orbitalinin olmasi gerekiyor . Bu nedenle 3s2 deki 2 elektronundan birini bir sonraki kabuga uyarir. Asagidaki gibi bag yapmaya hazir 5 tane yari dolu orbital olusturur.

Cl atomunun da çiftlesmemis elektronlari bu orbitallere yerleserek sp3d hibritlesmesini gerçeklestirirler.
PCl5 üçgen çiftpiramit geometrisindeki hibritlesmeyi gerçeklestirir.
d2sp3 Hibritlesmesi
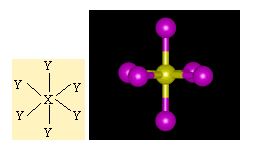
SF6 örnegi verilerek d2sp3 hibritlesmesi açiklanabilir. Öncelikle atomlarin elektron dizilimleri yazilir.
16S 1s2 2s22p63s23p4
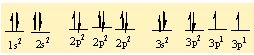
S' nin 6 tane bag yapabilmesi için 6 tane yari dolu orbitalinin olmasi gerekiyor . Bu nedenle 3s2 deki 2 elektronundan birini bir sonraki kabuga uyarir. Asagidaki gibi bag yapmaya hazir 6 tane yari dolu orbital olusturur.
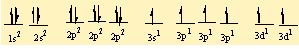
F atomunun da çiftlesmemis elektronlari bu orbitallere yerleserek sp3d2 hibritlesmesini gerçeklestirirler.
SF6 oktahedral geometrisindeki sp3d2 hibritlesmesini gerçeklestirir.