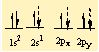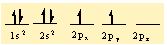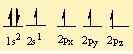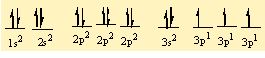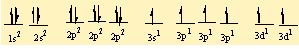Ziyaretçi
kimyasal bağ
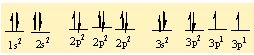
moleküller, iyonlar, kristaller, metaller ve öteki kararlı maddelerdeki atomları bir arada tutan etkileşimler. Birbirine yaklaşan atomların çekirdekleri ve elektronları karşılıklı etkileşime girer ve bunun sonucunda atomlar, toplam enerjileri tüm öteki diziliş biçimlerinden daha düşük olacak biçimde uzayda yerleşirler. Bir atom grubunun toplam enerjisi, grubu oluşturan tek tek atomların enerjilerinin toplamından daha düşük olduğunda bu atomlar kimyasal olarak bağlanır; aradaki bu enerji farkına bağlanma enerjisi denir. Bir atomun oluşturabileceği bağ sayısına o atomun değerliği (valans) denir.
Sponsorlu Bağlantılar
Örneğin, oksijenin değerliği iki, hidrojenin değerliği ise birdir ve iki hidrojen atomu bir oksijen atomu ile birleşerek bir su molekülü ya da iki hidrojen atomu iki oksijen atomu ile birleşerek bir hidrojen peroksit molekülü oluşturur. Bir atomun değerliği, atomun değerlik kabuğundaki, yani en dış kabuğundaki eşlenmemiş elektronların sayısına eşittir. İlk kimyasal bağ kuramlarında, molekül oluşturan bir atomun elektronlarının, asal gazlardaki gibi kararlı bir yerleşim düzenine girdiği kabul edilmişti. En basit kimyasal bağ tipi, iyon (elektro- valans) bağıdır.
Bu tür bağlarda, nötr atomlardan birinden öbürüne bir elektron aktarılır ve sonuçta oluşan yüklü parçacıklar elektrostatik çekim kuvvetiyle bir arada tutulur. Sodyum klorür (sofra tuzu) iyon bağıyla bağlanmış tipik bir bileşiktir. Kararlı neon atomundan bir fazla elektronu bulunan sodyum atomu, bu fazla elektronunu, kararlı argon atomuna benzeyebilmesi için bir fazla elektrona gerek duyan klor atomuna verir. Böylece oluşan yüklü gruplar (Na+ ve Cl), elektrostatik kuvvetlerle bir arada tutulur. Kükürt atomunun ise argonun elektron yerleşimine ulaşmak için iki elektrona gereksinimi vardır. İki sodyum atomu ile birleşerek bu eksik elektronlarını tamamlar ve sodyum sülfürü (Na2S) ya da iki değerlik elektronu olan bir kalsiyum atomu ile birleşerek kalsiyum sülfürü (CaS) oluşturur.
İyon bağı, organik bileşiklerin çoğunun ve inorganik bileşiklerin bir bölümünün oluşumunu açıklamak bakımından yeterli değildir. Örneğin, klor atomunun değerlik elektronu sayısı yedidir ve klor molekülündeki (CI2) bağlanma bir atomdan öbürüne elektron aktarımıyla oluşmamıştır; bu tür bir aktarım bir asal gaz atomunun kararlı elektron yerleşimini kazandırmaz. İyon bağıyla bağlanma, iyonik olmayan klor molekülünün kararlılığını açıklayamaz. Bu tür bağlar, atomların arasında gerçekleşen elektron paylaşımıyla açıklanabilir ve ortaklaşım (kovalans) bağı olarak adlandırılır. Klor molekülünün kararlılığı, iki atomun bir çift elektronu ortak kullanarak her birinin argon atomunun kararlı elektron yerleşimine ulaşmasıyla açıklanabilir. Oksijen atomunun iki eşlenmemiş elektronu vardır ve değerliği ikidir. İki oksijen atomu iki çift elektronu ortak kullanarak iki ortak- laşım bağı oluşturur ve her biri kendi içinde neon atomunun kararlı elektron yerleşimine ulaşır. Oksijen molekülünün (O2), bir çift bağı vardır. Karbon atomunun ise eşlenmemiş değerlik elektronu sayısı dörttür. Asetilen molekülünde (C2H2), her karbon atomu ile bir hidrojen atomu arasında ortaklaşım bağı kurulur, karbon atomları ise kendi aralarında üç çift elektronu paylaşır; genellikle H-C=C-H açık formülüyle gösterilen asetilen, bir karbon-karbon üçlü bağı içerir.
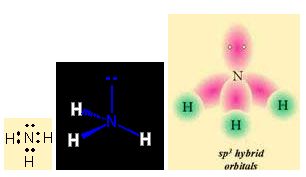
Bazı ortaklaşım bağlı moleküllerde, elektron çifti bağındaki her iki elektronu da bileşenlerden yalnız biri sağlar. Amonyak molekülü (NH3), kararlı neon atomunun elektron yerleşimine sahiptir; azot atomunun beş değerlik elektronundan üçü, hidrojen atomlarının birer elektronu ile eşlenerek normal ortaklaşım bağları kurar, kalan iki değerlik elektronu da, bir hidrojen iyonu (H+) ile birlikte amonyum iyonu (NHJ) oluşturabilen bir yalnız çifttir.
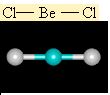
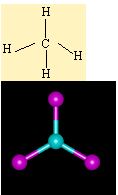
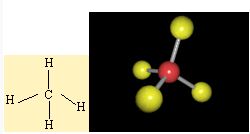
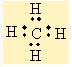
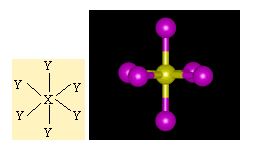
Moleküllerin bağlanma türü biçimlerini de belirler. Metan molekülündeki karbon atomunun dört eşlenmemiş elektronu hidrojen atomları ile dört ortaklaşım bağı kurar. Oluşan bağlardaki dört elektron çifti uzayda karşılıklı itişleri en az olacak biçimde konumlanır. Bu nedenle metan dörtyüzlü yapıda bir moleküldür. Amonyak molekülü, bağ yapan üç elektron çifti ve bir bağlanmamış elektron çifti içerir; bu elektron çiftleri de yaklaşık olarak dörtyüzlü bir düzende yerleşirler. Ama hidrojen atomları ortaklaşım bağındaki elektronları azot atomlarından uzağa doğru çektiğinden, bağ kuran elektronlar arasındaki itme kuvveti yalnız çift ile bağ kuran çiftler arasındaki itme kuvvetlerinden daha azdır; bu nedenle amonyak molekülündeki (H-NH) bağ açısı dörtyüzlünün açısından biraz daha küçüktür. Su molekülünde ise değerlik kabuğunda ortaklaşım yapan iki elektron çifti ve iki yalnız çift bulunur; yalnız çiftin etkileşimleri, yalnız çiftler ile bağ yapan çiftler arasındaki etkileşimlerden daha büyük olduğundan, suyun (H-O-H) bağ açısı amonyağın (H-N-H) bağ açısından daha küçüktür.
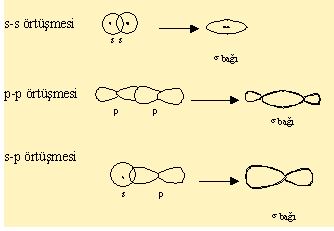
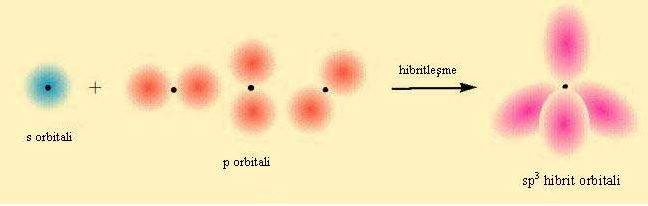
Moleküllerdeki bağlanmanın daha ayrıntılı tanımı kuvantum mekaniğinin ilkelerine dayalı olarak yapılır. Ne var ki moleküllerin yapısına ilişkin kuvantum mekaniği denklemleri çok karmaşık olduğundan tam olarak çözülemez. Bu nedenle değerlik bağı yöntemi ve molekül yörüngemsisi yöntemi olmak üzere iki yaklaşık yöntem kullanılır. Molekülü oluşturan atomları temel alan değerlik bağı yöntemi, kimyasal bağları elektron çiftleriyle açıklayan kuramın kuvantum mekanik biçimidir. Molekül yörüngemsisi yöntemi ise, atomdaki yörüngemsi kuramının moleküller için genelleştirilmiş biçimidir. Ne değerlik bağı, ne de molekül yörüngemsisi yöntemi kimyasal bağlanmayı tam olarak aydınlatır; ama her iki yöntem de aynı sonuçları verir.
Bazı moleküllerdeki kimyasal bağlar, atomlar arası elektron çifti bağlarıyla, yani iki merkezli bağlarla açıklanamaz. Bor hid- rürlerin çoğundaki bağlanma çok merkezli bağlarla açıklanır. Örneğin, diboranda (B2H6), dört normal ortaklaşım bağı ve bir elektron çiftinin üç atomla da ilgisinin olduğu iki B-H-B üç merkezli bağ bulunur. Bor atomları bu yolla neon atomunun kararlı elektron yerleşimine sahip olur.
Benzen gibi doymamış, eşlenik ve aromatik moleküller ise yerleşik olmayan yörüngemsilerle (yörüngemsi, moleküldeki elektronların enerjilerini ve dağılımını tanımlayan bir kuvantum mekaniği fonksiyonudur) açıklanır. Benzen molekülü düzlemsel bir moleküldür, karbon atomlanndan her biri düzgün bir altıgenin köşelerinde yer alır ve her karbon atomuna bir hidrojen atomu bağlıdır. Bu düzen her karbon atomunun dört değerlik elektronundan üçünün kullanılmasıyla elde edilebilir. Kalan altı değerlik elektronu ise tüm karbon atomları üzerindeki yörüngemsilerde hareket eder.
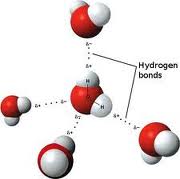
Kimyada en önemli bağlar iyon ve ortaklaşın! bağlan olmakla birlikte, bazı moleküllerde bulunan hidrojen bağları da önemli bir bağ türüdür. Bir ortaklaşım bağının yaklaşık onda biri kadar dayanımı olan hidrojen bağları oldukça zayıf bağlardır ve hidroksil grupları (OH) ya da amin grupları (NH2) arasında etkileşimler vardır. Proteindeki hidrojen bağları da son derece önemli bir rol oynar.
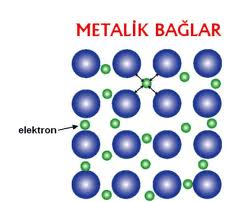
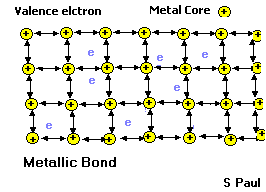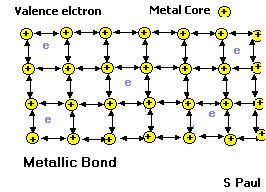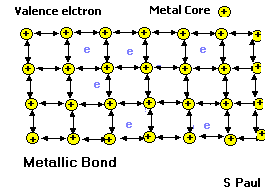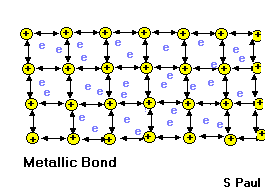
Kristal yapılı metallerin ve alaşımların çoğunda görülen bir başka çekirdeklerarası bağlanma biçimi de metal bağlarıdır ve bunlar atomlan bir arada tutan çok güçlü kuvvetlerdir.
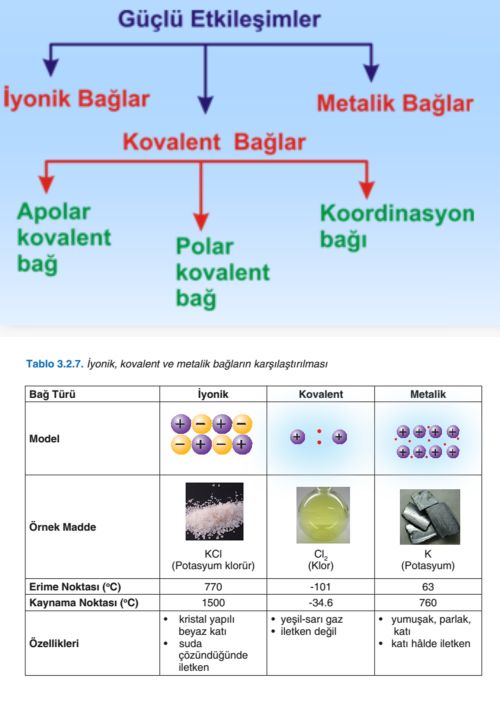
İyonik Bağlar
Elektronegatiflikleri farkli olan iki atom arasindaki elektron alis verisi sonucunda olusan (+) ve (-) yüklü iyonlar birbirlerine iyonik baglarla baglanir. Bu iyonlar arasindaki bag elektrostatik çekim kuvvetidir. Örnek olarak NaCl verecek olursak Na (sodyum) bir elektron vererek Na+ katyonunu olusturur ve bu elektron Cl (klor) tarafindan alinir ve Cl- anyonunu olusturur. Iki zit yüklü iyon arasindaki elektrostatik çekim nedeniyle iyonik bir bag olusur. Bu kuvvetli çekim kuvvetinden dolayi erime noktalari yüksektir.
İyonik Bileşik Oluşturma Kuralları
Iki farkli cins atomun iyonik bir bilesik olusturup olusturamayacagi iyonlasma enerjisi, elektron ilgisi, elektronegatiftik gibi özelliklerinden yararlanilarak anlasilir.
İyonlaşma Enerjisi: Metalin iyonlasma enerjisi ne kadar küçükse, yani ne kadar düsük bir enerji ile elektron verebiliyorsa o kadar kolay iyonik bilesik olusturabilme yetenegi vardir. Periyodik tabloda soldan saga gidildikçe katyonun üzerindeki pozitif yük artacagi için elektronun atomdan ayrilmasi güçlesir iyonlasma enerjisi de büyür: Na+, Mg2+ , Al3+,... sirasinda sodyumun tüm bilesikleri iyonikken magnezyum ve alüminyum kovalent bagli bilesikler olusturabilir.
Elektron İlgisi: Ametalin elektron ilgisi ne kadar büyük olursa iyonik bilesigin olusumu da o derece daha kesin olur. Yine periyodik tabloda soldan saga gidildikçe anyon üzerindeki negatif yük sayisi azalir ve elektron ilgisi artarak iyonik bilesik olusturmaya egilimlenir. C 4-, N3-, O 2-, F - sirasina göre flor en yüksek iyonik bilesik yapma yetegine sahiptir.
Kristal Yapıyı Oluşturma Enerjisi: Elektron alis verisi ile katyon ve anyon olustuktan sonra bu iki iyon birbirlerini çekerek kristal yapiyi meydana getirir. Kristal yapiyi meydana getirme esnasinda bir enerji açiga çikar. Meydana gelen bu enerjiyle kristal yapiyi olusturma sansida artar.
Elektronegatiflik: Bilesik yapan iki ayri cins atomun elektronegatiflik degerleri birbirinden çikarilir. Eger bu fark 1.7 den büyükse bag iyonik bagdir. Atomlar arasindaki elektronegativite farki 1.7 ile 0.5 arasinda ise bag polar kovalent bag, 0.5 den küçük ise bag apolar kovalent bag olarak nitelendirilir.
NaF bilesiginde, Na atomunun elektronegativitesi 0.9, Florun ise 4.0 dir.
Elektronegativite farki 4.0- 0.9 = 3.1 Bunun neticesinde NaF bilesigindeki bag iyonik bagdir.
Kovalent Bağlar
Elektronegatiflikleri birbirine yakin veya ayni olan atomlarin elektronlarini ortaklasa kullanmalari sonucunda olusan baga kovalent bag denir. H2, F2, Cl2, O2, P4 , S8 kovalent bagli moleküllerdir.
Lewis kuralina göre
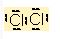
Cl ile Cl birer elektronlarini ortaklasa kullanarak kovalent bag olusturur. Bu elektron çifti bag olarak çizgi seklinde gösterilir.
Cl-Cl
Ayni iki atom arasinda bir elektron çiftinden daha fazla elektron ortaklasa kullanilabilir. Buna çoklu kovalent bag ismi verilir. Çift bagda, iki atom arasinda iki elektron çifti, üç bagda ise üç elektron çifti bulunur.
Kovalent Bağlı Moleküllerden Oluşan Maddelerin Özellikleri
Kovalent bagli moleküllerden olusan maddeler, iyonik ve metalik bagli maddelere nazaran daha düsük kaynama ve erime noktasina ve ayrica daha düsük erime ve buharlasma isilarina sahiptirler. Çünkü bir iyonik bilesigi eritirken çok kuvvetli olan iyonik baglari kirmak için yüksek sicakliga isitmak gereklidir. Halbuki moleküllerden olusan bir kati maddeyi eritmek için iyonik baga göre çok daha zayif olan moleküller arasi çekim kuvvetlerini yenmek, gerekeceginden daha düsük bir sicakliga isitmak kafi olacaktir. Düsük yogunlukludurlar, gaz sivi ve kati haldedirler. Kati halde iken kirilganve zayif yumusak veya mumsu bir yapilari vardir. Elektrik ve isiyi çok az iletirler. Genellikle organik çözücülerle çözünebilirler.
Polar Kovalent Bağlar
Elektronegatiflikleri birbirinden farkli iki atomun olusturdugu kovalent baglarda ortak kullanilan elektron çifti esit olarak paylasilmaz. Daha elektronegatif olan atom tarafindan bu elektron çifti daha fazla çekilir ve böylece polar kovalent bag olusur.
Bazi atomlar arasindaki elektronegatiflik sirasi asagida verilmistir.
F>O>N>Cl>Br>C>I>H
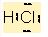
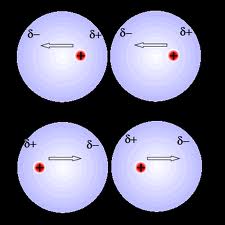
Cl (klor) atomunun elektronegatifligi H (hidrojen) atomundan çok fazla oldugu için ortak elektronlar klor atomu tarafindan daha çok çekilir ve hidrojen kismi pozitif yükle yüklenirken, klor kismi negatif yükle yüklenir. Böylelikle dipol moment olusur.
Dipol momenti olan moleküller polardir.
H+δ à Cl-δ
Koordine Kovalent Bağlar
Bag yapmak için elektronlar tek atom tarafindan veriliyorsa, bu tür kovalent baglara koordine kovalent bag denir.
N (azot) atomu üç bag yapabilir. N atomu üzerinde bulunan ortaklanmamis elektron çifti hidrojenle dördüncü bag yapiminda kullanilir. Böylece bu bagin olusumunda elektronlar azot tarafindan saglanmis olur.
BAKINIZ
İyonik Bağ
Kovalent Bağ
Metalik Bağı
Hidrojen Bağı
İyon Nedir? İyon Çeşitleri (Katyon ve Anyon)
Molekül Yapısı - Moleküler Yapı Nedir?
Son düzenleyen Safi; 9 Aralık 2016 05:56

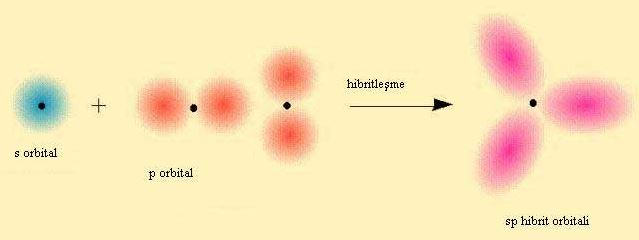
 Kimyasal Bağlar ve Hibritleşme
Kimyasal Bağlar ve Hibritleşme