silisyum (Si)
periyodik tablonun IVa grubunda (karbon grubu) yer alan ametal kimyasal element.
Yerkabuğunun yüzde 27,7sini oluşturan silisyum oksijenden sonra Yerde en bol bulunan elementtir.
İlk olarak 1824te İsveçli kimyacı Jöns Jacob Berzeliusun bulduğu silisyum doğada serbest halde bulunmaz, ama hemen hemen bütün kayaçlarda, kum, kil ve topraklarda ya oksijenli bileşiği olan silis (SİO2, silisyum dioksit) halinde ya da oksijen ve alüminyum, magnezyum, kalsiyum, sodyum, potasyum, demir gibi başka elementlerle oluşturduğu silikatlar halinde bulunur. Ayrıca doğal sularda, atmosferde (silisli toz halinde), pek çok bitkide ve bazı hayvanların iskeletlerinde, dokularında, vücut sıvılarında da silisyum bileşikleri vardır.
Katışıksız silisyum sert, koyu gri renkli, metal parlaklığında bir katıdır ve kristal yapısı elmas biçimindeki karbonun aynısıdır. Silisyumun birçok fiziksel ve kimyasal özelliği karbonunkine benzer. Kahverengi ve toz halinde silisyum da tanımlanmıştır, ama bu da mikrokristal yapıdadır. Element haldeki silisyum sanayide, oksidinin elektrik fınnlarında kok kömürüyle indirgenmesi yoluyla hazırlanır. Küçük ölçekte ise oksidinin alüminyumla indirgenmesiyle elde edilebilir.
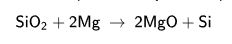
Silisyum da karbon gibi oda sıcaklığında tepkin değildir, ama ısıtıldığında şiddetle tepkimeye girerek halojenlerle halojenürleri, bazı metallerle de silisürleri oluşturur. Hidroflüorik asit dışındaki asitlerden etkilenmez. Akkor sıcaklığında su buharının ya da oksijenin etkisiyle yüzeyinde silisyum dioksit katmanı oluşur. Silisyum ve karbonun elektrik fırınında 2.000°C-2.600°C arasındaki sıcaklıklarda birleşmesiyle önemli bir aşındırıcı olan silisyum karbür (karborundum, SiC) elde edilir. Silisyumun hidrojenle tepkimeye girmesi sonucunda, oda sıcaklığında gaz halinde bulunan ve silanlar olarak bilinen bir dizi hidrür; hidrokarbon gruplarıyla birleşmesiyle de birçok organik silisyum bileşiği oluşur.
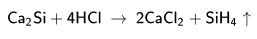
Element haldeki silisyumun birkaç uygulama alanı vardır. Metalürjide indirgeyici ve çelik, pirinç ve tunç üretiminde alaşım maddesi olarak kullanılır. Katışıksız silisyumdan fotoelektrik aygıtlarda, transistorlarda ve başka elektronik elemanlarda yararlanılır. Silisyumun en önemli bileşikleri silis ve silikatlardır. Kum ve kil biçimindeki silis beton ve tuğlanın yanı sıra yüksek sıcaklıklara dayanıklı tuğlamsı (refrakter) yapımında kullanılır. Kuvars minerali halindeki silisten ise ısıyla yumuşatılarak cam eşyalar üretilir. Suda çözünmeyen silikatların çoğundan da cam eşya ve emaye, çanak çömlek, porselen ve başka seramik malzemelerin üretiminde yararlanılır. Su camı olarak bilinen sodyum silikatlar sabun yapımında, ahşap malzemenin çürümesini önlemede, yumurtaların saklanmasında, çimento olarak ve boyalarda kullanılır. Silikonlar ise silisyum, oksijen, karbon ve hidrojenden yapay yolla üretilen organosilisyum oksitlerdir. Bunlar eylemsiz ve yüksek sıcaklıklara olağanüstü dayanıklı olmaları nedeniyle yağlayıcılarda, hidrolik sıvılarında, su geçirmeyen malzemelerde, vernik ve emayelerde kullanılırlar.
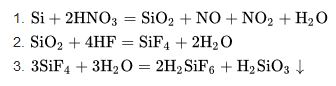
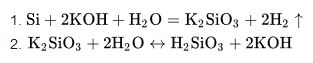
Silisyumun silisyum-28 (yüzde 92,21), silisyum-29 (yüzde 4,70) ve silisyum-30 (yüzde 3,09) gibi üç kararlı izotopu ve dört radyoaktif izotopu bilinmektedir.