Ziyaretçi
Organik Kimya
Organik kimya, kimyanın bir alt başlığı olup karbon-karbon bağı içeren bileşiklerin kimyasını inceler. Moleküller organik bileşiklerin temel yapısını oluşturur. Moleküller birbirlerine kovalent bağlarla bağlıdır. Erime ve kaynama noktaları düşüktür, kolay buharlaşırlar.
Organik kimyayı anlayabilmek için öncelikle atomun yapısını ve kimyasal bağlanmasını çok iyi bilmek gerekir.
Konu Başlıkları
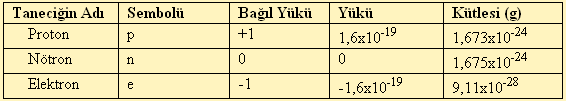
Bir elementin atom numarası (Z), proton sayısı (p) na eşittir. Yüksüz atomalarda, proton sayısı (p) elektron sayısına (e) eşittir. Kütle numarası ( n ) ise proton ve nötron sayılarının toplamınan eşittir.
01.01.01. s orbitali
S orbitali küresel simetrik bir yapı gösterir. En fazla 2 elektron alır. Baş kuantum sayısı büyüdükçe sorbitalinin enerjisi artar.
İkinci veya daha üst temel enerjidüzeylerinde bulunur. Px, Py ve Pz olarak 3 orbitali vardir ve toplam 6 elektrona sahiptir.



01.01.03. d orbitali
Üçüncü ve daha üst temel enerji düzeylerinde bulunur. 5 orbitali ve toplam 10 elektronu vardır.
01.01.04. f orbitali
Dördüncü ve daha üst temel enerji düzeylerinde bulunur7 orbitali ve toplam 14 elektronu vardır.

Elektronlar orbitallere doldurulurken yukarıdaki sıra takip edilir.
Örneğin atom numarası 7 olan N un elektron dağılımı şu şekilde olur.
01.02. Lewis Kuralı
Soygazlar son kabuklarında sekiz elektron bulundururlar. Yani değerlik elektron sayısı sekizdir ve karalı bir yapıları vardır. Atomlarda, periyodik tabloda kendine en yakın soygaza benzemek için elektron alışverişinde bulunurlar veya elektronlarını bağ yapacakları diğer atom ile ortaklaşa kullanırlar. Atomların son kabuklarında bulunan elektronlar 4 taneden azsa önce bunlar teker teker yerleştirilir. 4 ten sonraki elektronlar ise eşleşmemiş elektronların yanına eşleştirilir.
02.01. İyonik Bağlar
Elektronegatiflikleri farklı olan iki atom arasındaki elektron alış verişi sonucunda oluşan (+) ve (-) yüklü iyonlar birbirlerine iyonik bağlarla bağlanır. Bu iyonlar arasındaki bağ elektrostatik çekim kuvvetidir.
Örnek olarak NaCl verecek olursak Na (sodyum) bir elektron vererek Na+ katyonunu oluşturur ve bu elektron Cl (klor) tarafından alınır ve Cl- anyonunu oluşturur. İki zıt yüklü iyon arasındaki elektrostatik çekim nedeniyle iyonik bir bağ oluşur. Bu kuvvetli çekim kuvvetinden dolayı erime noktaları yüksektir.
02.02. Kovalent Bağlar
Elektronegatiflikleri birbirine yakın veya aynı olan atomların elektronlarını ortaklaşa kullanmaları sonucunda oluşan bağa kovalent bağ denir.
02.03. Polar kovalent Bağlar
Elektronegatiflikleri birbirinden farklı iki atomun oluşturdurduğu kovalent bağlarda ortak kullanılan elektron çifti eşit olarak paylaşılmaz. Daha elektronegatif olan atom tarafından bu elektron çifti daha fazla çekilir ve böylece polar kovalent bağ oluşur. Bazı atomlar arasındaki elektronegatiflik sırası aşağıda verilmiştir.
Dipol momenti olan moleküller polardır.
Bağ yapmak için elektronlar tek atom tarafından veriliyorsa, bu tür kovalent bağlara koordine kovalent bağ denir.
N (azot) atomu üç bağ yapabilir. N atomu üzerinde bulunan ortaklanmamış elektron çifti hidrojenle dördüncü bağ yapımında kullanılır. Böylece bu bağın oluşumunda elektronlar azot tarafından sağlanmış olur.
Organik moleküllerde bağlanma tamamen kovalent bağdır. Bunlar
03.01. s (Sigma bağı)

Karbon atomunun elektron dağılımı 6C 1s2 2s22p2 şeklindedir.
Bu örnekle karbon atomunun her zaman 4 bağ yaptığını gördük. Diğer bir gösteriş şekliyle C değerlik bağ elektron sayısı 4 tür (2s22p2) Buradaki4 tane elektron C atomu üzerine tek tek yerleştirilir. H atomunun değerlik elektron sayısı 1 (1s1) olduğundan ve 4 tane H atomu bulunduğu için her bir H atomunun elektronu C atomunun elektronu ile eşleşir.
Ortaklanmamış elektronlarda sigma bağı gibi düşünülür. Buna da örnek olarak NH3 (amonyak) verebiliriz.
7N 1s2 2s22p3
Normalde N (azot) H (hidrojen) ile 3 bağ yapıyor gibi gözüküyor ama eğer lewis yapısını çizecek olursak,
Bağ elektronları birbirini iter. Ortaklanmamış elektron çiftinin itme kuvveti bağ elektronlarınkinden daha fazladır. Ortaklanmamış elektronların itme kuvveti fazla olduğu için beklenen 109.5° açıdan sapma gösterir.
Diğer bir özel durum ise atomlar arasındaki çoklu bağlar tek bağ olarak kabul edilir. Budurum içinde en iyi örnek etilen verilebilir.

Buradaki C-C bağları arasında sürekli dönme hareketi vardır. Bu yüzden sayısız şekilde yapı vardır. Buna konformasyon denir.
Sponsorlu Bağlantılar
Organik kimyayı anlayabilmek için öncelikle atomun yapısını ve kimyasal bağlanmasını çok iyi bilmek gerekir.
Konu Başlıkları
01. Atom Yapısı ve Orbitaller
01.01. Orbitaller
01.01.01. s orbitali
01.01.02. p orbitalleri
01.01.03. d orbitali
01.01.04. f orbitali
01.02. Lewis Kuralı02. Kimyasal Bağlar
02.01. İyonik Bağlar03. Hibritleşme
02.02. Kovalent Bağlar
02.03. Polar kovalent Bağlar
02.04. Koordine Kovalent Bağlar
03.01. s (Sigma bağı)
03.02. p (pi Bağı)

Bir elementin atom numarası (Z), proton sayısı (p) na eşittir. Yüksüz atomalarda, proton sayısı (p) elektron sayısına (e) eşittir. Kütle numarası ( n ) ise proton ve nötron sayılarının toplamınan eşittir.
A= p + nElektronları çekirdek etrafında bir bulut şeklinde göstermek mümkündür. Bulutların yoğun olduğu yerlerde elektronların bulunma olasılığı fazladır ve bulutlar orbital olarak adlandırılır. Orbitaller s, p, d, f harfleriyle isimlendirilir.
A
X
Z şeklinde gösterilir.
Baş kuantum sayısı (n) orbitalin temel enerji düzeyini, n2 ise orbital sayısını verir. Her orbitalde en fazla 2 elektron bulunur.
n = 1 ise sadece s orbitali01.01. Orbitaller
n = 2 ise s ve p orbitali
n = 3 ise s, p, d orbitali
n = 4 ve yukarısında ise s, p, d ve f orbitali bulunmaktadır.
01.01.01. s orbitali
S orbitali küresel simetrik bir yapı gösterir. En fazla 2 elektron alır. Baş kuantum sayısı büyüdükçe sorbitalinin enerjisi artar.
01.01.02. p orbitalleri
İkinci veya daha üst temel enerjidüzeylerinde bulunur. Px, Py ve Pz olarak 3 orbitali vardir ve toplam 6 elektrona sahiptir.



01.01.03. d orbitali
Üçüncü ve daha üst temel enerji düzeylerinde bulunur. 5 orbitali ve toplam 10 elektronu vardır.
01.01.04. f orbitali
Dördüncü ve daha üst temel enerji düzeylerinde bulunur7 orbitali ve toplam 14 elektronu vardır.

Elektronlar orbitallere doldurulurken yukarıdaki sıra takip edilir.
- Önce cekirdeğe en yakın olan en düşük enerjili olan 1s orbitalinden başlanır (Aufbau kuralı)
- Bir orbitalde en fazla iki elektron olabilir. Bu elektronların spinleri (dönme yönleri) farklı olmalıdır (Pauli kuralı)
- Hund kuralına göre eşit enerjili orbitallerin (px, py, pz) herbiri bir elektron almadıkça ikinci elektronu almazlar.
Örneğin atom numarası 7 olan N un elektron dağılımı şu şekilde olur.
7N 1s2 2s22p3Şekilde de görüldüğü gibi p orbitallerinin elektronları tek tek yerleştirilir. 20Ca atomunun ise elektron dağılımı 1s2 2s22p63s23p64s2 şeklindedir.
01.02. Lewis Kuralı
Soygazlar son kabuklarında sekiz elektron bulundururlar. Yani değerlik elektron sayısı sekizdir ve karalı bir yapıları vardır. Atomlarda, periyodik tabloda kendine en yakın soygaza benzemek için elektron alışverişinde bulunurlar veya elektronlarını bağ yapacakları diğer atom ile ortaklaşa kullanırlar. Atomların son kabuklarında bulunan elektronlar 4 taneden azsa önce bunlar teker teker yerleştirilir. 4 ten sonraki elektronlar ise eşleşmemiş elektronların yanına eşleştirilir.
7N 1s2 2s22p302. Kimyasal Bağlar
8O 1s2 2s22p4
02.01. İyonik Bağlar
Elektronegatiflikleri farklı olan iki atom arasındaki elektron alış verişi sonucunda oluşan (+) ve (-) yüklü iyonlar birbirlerine iyonik bağlarla bağlanır. Bu iyonlar arasındaki bağ elektrostatik çekim kuvvetidir.
Örnek olarak NaCl verecek olursak Na (sodyum) bir elektron vererek Na+ katyonunu oluşturur ve bu elektron Cl (klor) tarafından alınır ve Cl- anyonunu oluşturur. İki zıt yüklü iyon arasındaki elektrostatik çekim nedeniyle iyonik bir bağ oluşur. Bu kuvvetli çekim kuvvetinden dolayı erime noktaları yüksektir.
02.02. Kovalent Bağlar
Elektronegatiflikleri birbirine yakın veya aynı olan atomların elektronlarını ortaklaşa kullanmaları sonucunda oluşan bağa kovalent bağ denir.
Lewis kuralına göreCl ile Cl birer elektronlarını ortaklaşa kulanarak kovalent bağ oluşturur. Bu elektron çifti bağ olarak çizgi şeklinde gösterilir. Cl-Cl
02.03. Polar kovalent Bağlar
Elektronegatiflikleri birbirinden farklı iki atomun oluşturdurduğu kovalent bağlarda ortak kullanılan elektron çifti eşit olarak paylaşılmaz. Daha elektronegatif olan atom tarafından bu elektron çifti daha fazla çekilir ve böylece polar kovalent bağ oluşur. Bazı atomlar arasındaki elektronegatiflik sırası aşağıda verilmiştir.
F>O>N>Cl>Br>C>I>HCl (klor) atomunun elektronegatifliği H (hidrojen) atomundan çok fazla olduğu için ortak elektronlar klor atomu tarafından daha çok çekilir ve hidrojen kısmi pozitif yükle yüklenirken, klor kısmi negatif yükle yüklenir. Böylelikle dipol moment oluşur.
Dipol momenti olan moleküller polardır.
H+δ02.04. Koordine Kovalent BağlarCl-δ
Bağ yapmak için elektronlar tek atom tarafından veriliyorsa, bu tür kovalent bağlara koordine kovalent bağ denir.
N (azot) atomu üç bağ yapabilir. N atomu üzerinde bulunan ortaklanmamış elektron çifti hidrojenle dördüncü bağ yapımında kullanılır. Böylece bu bağın oluşumunda elektronlar azot tarafından sağlanmış olur.
03. Hibritleşme
Organik moleküllerde bağlanma tamamen kovalent bağdır. Bunlar
03.01. s (Sigma bağı)

03.02. p (pi Bağı)
P orbitallerinin dikey olarak örtüşmesi ile olur.CH4 molekülde C (Karbon) atomu ile H (Hidrojen) atomu arasindaki bağlanmayı şu şekilde açıklıyabiliriz.
Karbon atomunun elektron dağılımı 6C 1s2 2s22p2 şeklindedir.
Bu durumda karbon atomunun bağ yapabilecek 2 tane eşleşmemiş elektronu gözüküyor. Fakat 4 hidrojen atomu ile bağ yapması bekleniyor. Bu durumda 2s2 deki iki elektrondan biri 2pz orbitaline uyarılır. Böylece karbon atomunu 4 tane bağ yapabilecek yarı dolu orbitali oluşur.
Böylelikle hidrojen atomu 4 tane yarı dolu orbitale birer elektonunu vererek bağlanma yapar.
C bir tane s ve 3 tane p orbitalini kullanarak sp3 hibritleşmesini gerçekleştirdi.
Bu örnekle karbon atomunun her zaman 4 bağ yaptığını gördük. Diğer bir gösteriş şekliyle C değerlik bağ elektron sayısı 4 tür (2s22p2) Buradaki4 tane elektron C atomu üzerine tek tek yerleştirilir. H atomunun değerlik elektron sayısı 1 (1s1) olduğundan ve 4 tane H atomu bulunduğu için her bir H atomunun elektronu C atomunun elektronu ile eşleşir.
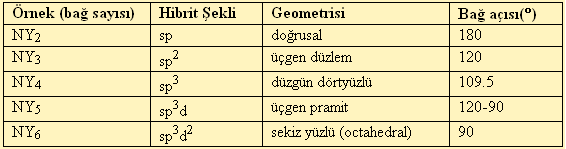
Kaç tane sigma bağı varsa bu o molekülün hibritleşme türünü gösterir.

Ortaklanmamış elektronlarda sigma bağı gibi düşünülür. Buna da örnek olarak NH3 (amonyak) verebiliriz.
7N 1s2 2s22p3
Normalde N (azot) H (hidrojen) ile 3 bağ yapıyor gibi gözüküyor ama eğer lewis yapısını çizecek olursak,
7N 1s2 2s22p3N'un 3 tane bağ yapabilecek elektronu bulunmaktadır. Buda H atomunun 1 s1 orbitalindeki bir elektron ile 3 tane bağ yapabileceğini gösteriyor.
N üzerindeki bağa katılmayan ortaklanmamış elektronlarda bağ gibi sayılacağından sp3 hibritleşmesi yapacaktır. Ortaklanmamış elektron çifti çekirdeğe daha yakındır. Bu yüzden s karakteri artar dolayısıyla bağ açısı artar.

Bağ elektronları birbirini iter. Ortaklanmamış elektron çiftinin itme kuvveti bağ elektronlarınkinden daha fazladır. Ortaklanmamış elektronların itme kuvveti fazla olduğu için beklenen 109.5° açıdan sapma gösterir.
Diğer bir özel durum ise atomlar arasındaki çoklu bağlar tek bağ olarak kabul edilir. Budurum içinde en iyi örnek etilen verilebilir.
6C 1s2 2s22p2
C atomu uyarılarak s orbitalindeki bir elektron p orbitaline uyarılır.
Buradaki hibritleşmeyen C' un dikey p bağları örtüşerek p bağını oluşturur. Böylelikle C yine 4 bağını tamamlamış olur. C-C arasındaki iki bağdan birisi s (sigma) diğerisi ise p bağıdır. Bu iki bağ tek bağ olarak kabul edileceğinden sp2 hibritleşmesi yapacaktır.

Diğer bir örnek ise asetilendir.
Asetilende C iki s (sigma) bağı yapar. Hibritleşmeye katılmayan py ve pz orbitalleri ise dikey şekilde örtüşerek 2 tane p bağını oluşturur. C- C arasındaki 2 tane p bağı ve birtane s bağı tek bağ olarak sayılacağından asetilen sp hibritleşmesi yapmaktadır.

Buradaki C-C bağları arasında sürekli dönme hareketi vardır. Bu yüzden sayısız şekilde yapı vardır. Buna konformasyon denir.
Kaynak: kimyaevi.org

 Organik Kimya
Organik Kimya













