Ziyaretçi
Kaç tür kovalent bağ vardır?
Kovalent Bağ Nasıl Tanımlanır, Kovalent Bağ Türleri Nelerdir?
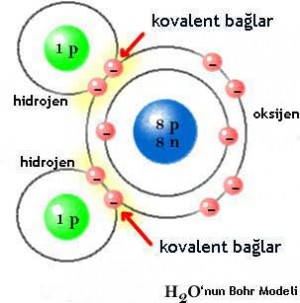
- Ametaller, bağ oluşumunda kendi aralarında elektron alış verişi yapamazlar. Bu nedenle oktetlerini tamamlamak için elektronlarını ortaklaşa kullanırlar. Ametal atomlarının elektronlarını ortaklaşa kullanarak yaptıkları bu bağ, kovalent bağ olarak tanımlanır. Kovalent bağ, polar kovalent bağ ve apolar kovalent bağ olmak üzere iki türde incelenir
- CCl4 (Metan)
- NH3 (Amonyak)
- H2O (Su)
- CO2 (Karbondioksit)
Sponsorlu Bağlantılar
Son düzenleyen Safi; 22 Kasım 2016 02:39

 Kovalent bağ ve çeşitleri nelerdir?
Kovalent bağ ve çeşitleri nelerdir?