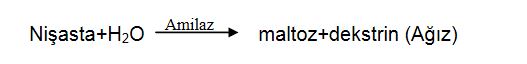İki veya daha fazla maddenin birbiri ile etkileşmesi sonucu kendi özelliklerini kaybederek yeni özellikte maddeler oluşturmasına
kimyasal olay denir.
Bir dizi kimyasal olay, tek bir kimyasal denklemle ifade edilebilir.Kimyasal olaylara kısaca
tepkime denir.
kimyasal tepkimelerde değilmyen özellikler - toplam kütle -atom sayısı ve hacmı
- toplam proton sayısı
- toplam nötron sayısı
- kütle numaraları
- toplam elektron sayısı
- çekirdek kararlılıkları
- 1 Kimyasal Tepkimelerde Değişebilen Özellikler
- 1.1 Sentez Tepkimeleri
- 1.2 Analiz tepkimeleri
- 1.3 Metallerin Asitlerle Tepkimeleri
- 1.4 Asit Baz Tepkimeleri
- 1.5 Yanma Tepkimeleri
- 2 Tepkime kabı
- 3 Tepkime ısısı
- 4 Tepkime hızı
Kimyasal Tepkimelerde Değişebilen Özellikler - Atomların hacmi veya çapı
- Atomların elektron düzenleri ve sayıları..
- Toplam potansiyel enerji
- Toplam mol sayısı
- Toplam molekül sayısı
- Toplam hacim
- Renk,koku,tat gibi fiziksel özellikler
Kimyasal Tepkimesinin çeşitleri
Sentez Tepkimeleri
İki ya da daha fazla basit yapılı madde daha karmaşık yapılı bir madde oluşturuyorsa böyle tepkimler
sentez tepkimeleri olarak adlandırılır.Ayrıca
birleşme tepkimeleri de denir.
2H2 + O2 ====> 2H2O
Analiz tepkimeleri
Ayrıştırma tepkimelerinin sentez tepkimelerinin tersidir.Karmaşık yapıdaki bir madde kendisini oluşturan daha basit yapılı maddelere ayrışıyorsa bu tepkimeler
analiz tepkimeleri(ayrışma)dır. Ayrıca
bozulma tepkimeleri de denir.
2 H2O ====> 2H2 + O2
Metallerin Asitlerle Tepkimeleri
Metaller asitlerle tepkimeye girdiklerinde tuz ve hidrojen gazı açığa çıkar.Bu tür tepkimelere
metallerin asitlerle tepkimeleri denir.
Zn + 2HCl ====> ZnCl2O
Asit Baz Tepkimeleri
Asit ve baz tepkimeleri sonucunda ürün olarak tuz ve su oluşur.Bu tepkimeye
nötürleşme tepkimesi de denir.
HCl + KOH ====> KCl H2O -->
'
4. Yer Değiştirme Tepkimeleri
Aktif olan bir elementin, kendinden daha az aktif olan (pasif) bir elementle yer değiştirmesi ile gerçekleşen tepkimelerdir.
Sulu çözelti tepkimelerinin birçoğunda ise anyon ve katyonların her ikisi de yer değiştirir. Çökelme ve nötrleşme tepkimeleri de yer değiştirme tepkimeleridir.
Çökelme:
Nötrleşme:
Organik bileşiklerde de yer değiştirme tepkimeleri vardır.
Yanma Tepkimeleri
Bir maddenin oksijen ile tepkimesine yanma(oksitlenme) denir.
Yapısında karbon ve hidrojen bulunduran organik maddeler(hidrokarbonlar) ve yapısında karbon, hidrojen ve oksijen bulunduran organik maddeler yandıklarında karbondioksit ve su oluşur.
Tepkime, kimyada iki veya daha çok maddenin başka madde veya maddelere dönüştüğü hadise. Reaksiyon da denir. Kimyasal tepkimede tepkimeye giren maddelerin özellikleri kaybolurken değişik özelliklerde yeni maddeler ürün olarak ortaya çıkar. Fakat tepkimede toplam kütle değişmez.
Bir kimyasal tepkimede bağ oluşturan elektronların enerji soğurmasıyla bağ parçalanır. Bu durum yeni bağların oluşmasını mümkün kılar ve enerji açığa çıkar.
Bir bağın parçalanması için gerekli olan enerji yeni bir bağın oluşmasında açığa çıkan enerjiden daha az olduğunda, bu tepkimeye ısıveren (ekzotermik) tepkime, tersi olduğundaysa ısıalan (endotermik) tepkime denir. Yapısında temel element olarak karbon ve hidrojen içeren bileşikler oksijen ile tepkimeye giriyorsa ürün olarak karbondioksit ve su oluşur. Tepkimesinin denkleştirilmesi için daha önce belirttiğimiz gibi önce karbon, sonra Hidrojen ve en son Oksijen atomlarının sayıları eşitlenir. Bunun için organik bileştiğin katsayısı 1 kabul edilip CO2nin kat sayısı 1, H2Onun katsayısı 2 bulunur. Oksijenleri eşitlemek için önce ürünlerdeki Oksijen sayısı bulunur. 1CO2deki Oksijen sayısı; 1.2=2dir.2H2Odaki Oksijen sayısı; 2+2=4tür. Buna göre girenlerdeki O2nin katsayısı 2 yazılırsa Oksijen sayıları da eşitlenmiş olur. CH4+2O2--CO2+2H2O ÖRNEĞİN; eğer organik bileşiğin yapısında oksijen atomu varsa; C2H5OH+O2CO2+H2O CO2 ve H2Onun katsayıları C2H5OHın katsayısı 1 kabul edilerek sarayla 2 ve 3 olarak bulunur . C2H5OH+O2--2CO2+3H2O Şimdi ürünlerdeki oksijen sayısını bulalım 2 CO2 deki sayısı; 2*2=4 3H2O DAKİ SAYISI =4+3=7 O2nin katsayısını bulmak için bileşiğin yapısındaki sayısı toplam sayısından çıkarılır. 7-1=6 Buna göre O2nin yanına 6/2=3 yazılır.
Tepkime kabı Reaktör de denir. Laboratuvarlarda veya kimya sanayisinde kimyasal tepkimelerin gerçekleştiği kap veya cihazlara denir. Genellikle (cam), paslanmaz (çelik) veya kimyasal maddelerden etkilenmeyen herhangi bir alaşımdan yapılmışlardır.
Tepkime ısısı
Bir kimyasal tepkimede bütün maddeleri aynı sıcaklıkta tutabilmek için tepkime sistemine eklenmesi veya sistemden uzaklaştırılması gereken ısı miktarıdır. Tepkime sisteminin içinde bulunduğu kabın basıncı sabit tutulduğunda ölçülen tepkime ısısı aynı zamanda (entalpi) olarak bilinen (termodinamik) nitelikteki değişimi, yani tepkime sonucunda oluşan ürünlerin entalpisiyle tepkimeye girenlerin entalpisi arasındaki farkı gösterir. Böylece sabit (basınç)ta tayin edilen tepkime ısısı DH sembolüyle gösterilen tepkime entalpisidir. DH negatif olduğunda tepkime ısıveren, tersi durumdaysa tepkime ısıalandır...
Mesela,
H2 + Cl2 → 2HCl + 44 kkal tepkimesinde tepkimeye giren H2 ve Cl2 moleküllerinde iki atomu bir arada tutan bağların koparılması enerji ister. Bu enerji sağlandığında atomlar arasındaki bağlar kopar ve atomlar yeni düzenlemeye girerek yeni bağlar (HCl bağları) oluştururken dışarıya enerji verilir. Bu tepkimede dışarı verilen enerji daha önce alınan enerjiden fazla olduğundan neticede dışarıya enerji verilmiş olur (ısıveren tepkime). Buna karşılık;
H2 + I2 + 12,4 kkal → 2HI tepkimesinde alınan enerji verilen enerjiden fazla olup bu tepkime de ısıalan tepkime olur.
Tepkime hızı
Tepkime hızı birim zamanda dönüşen madde miktarı anlamına gelir. Tepkime hızlarını karşılaştırabilmek için birim zamanda, birim hacimde değişen mol sayısı, yani derişim değişimi esas alınır. Bu durumda tepkime hızı (TH), birim zamanda madde derişimindeki değişim olarak ifade edilir. Mesela;
2NOCl(g) → 2NO + Cl2 tepkimesinde hız, NOCl, NO ve Cl2 derişimleri için ayrı ayrı yazılabilir. Tepkimeye giren NOCl yönünden tepkime hızı (TH1);
TH1 = NOCl derişimdeki azalma / zaman aralığı olarak tanımlanır. Buna göre NOCl ne kadar hızlı azalıyorsa, tepkime o kadar hızlı gerçekleşiyor demektir. Oluşan azot monoksit ve klora göre de;
Bir tepkimenin oluşması çarpışma teorisiyle izah edilir. Bu teoriye göre tepkime verecek tanecikler (molekül, atom veya iyon) mutlaka çarpışmalıdırlar. Ancak tepkime vermeleri için çarpışmaları da yetmez. Tepkime ancak moleküllerin uygun doğrultuda çarpışmaları ve ilaveten taneciklerin belirli bir enerjide olmalarıyla gerçekleşir. Tepkimenin gerçekleşmesi için taneciklerin sahip olmaları gereken minimum enerjiye
eşik enerjisi denir.
Eşik enerjiye sahip tanecikler çarpıştığında moleküller birbiri içine girer ve atomlar yeni bir düzenlemeye girebilecek biçimde karmaşık hale gelir. Bu arada taneciklerin hızı yani kinetik enerjisi azalır, potansiyel enerji de en yüksek seviyesine ulaşır. Yüksek potansiyel enerjili bu karmaşık hale aktifleşmiş kompleks adı verilir. Aktifleşmiş kompleksin enerji seviyesine varmak için gerekli enerjiye aktifleşme enerjisi denir.
Bir tepkimenin hızına tesir eden faktörleri:
- Tepkimeye giren maddelerin türü,
- Derişim,
- Sıcaklık,
- Katalizör
olarak sıralanabilir.
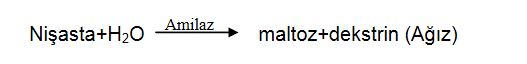
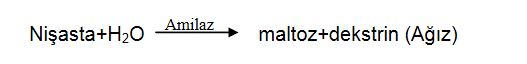

 Dilde gerçekleşen kimyasal tepkimeler nelerdir?
Dilde gerçekleşen kimyasal tepkimeler nelerdir?