Gaz
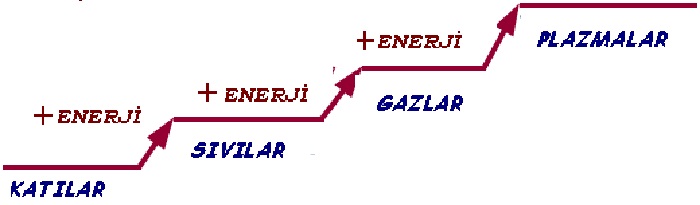
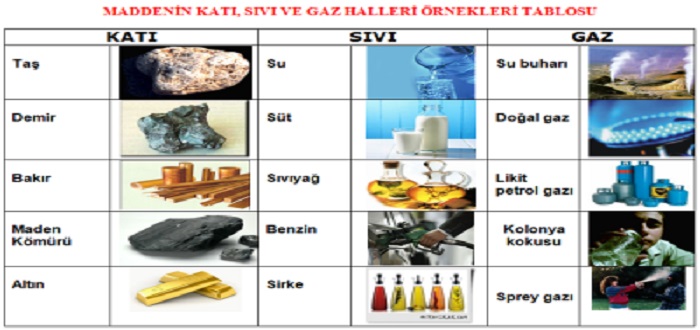
;Maddenin üç temel halinden biri. Sıvılardan ve katilardan belirgin özelliklerle ayrılan gazlarda, her parçacık, çevresindeki öteki parçacıklardan hemen hiç etkilenmeden üç boyutta hareket eder; sıvılarda ve katılarda ise her atomun ve molekülün hareketi, komşu parçacıkların uyguladığı kuvvetlerin etkisi altındadır. Gazın içinde serbestçe hareket eden atomlar ve moleküller, sürekli olarak birbirleriyle çarpışarak gazın tümüne yayılan ve içinde bulunduğu kabın duvarlarına etkiyen bir basıncın oluşmasına yol açarlar; bu nedenle gazların en önemli özelliklerinden biri, içinde bulundukları kabın tüm hacmini kaplamaları ve sıkıştırılabilmeleridir. Gaz, ısıtıldığında genleşerek yükselir, yeterli derecede soğutulduğunda ise sıvı halde yoğunlaşır. Gazların sıkıştırılabilme ve genleşme özelliklerinden sanayide ve günlük yaşamda yaygın olarak yararlanılır. Örneğin içten yanmalı motorlar, jet motorları ve roketler gazların bu özelliklerine dayalı olarak çalışır.Sponsorlu Bağlantılar
Termodinamik tanım.
Gazlar, neon ya da helyum gibi tekatomlu gazlardan, petrol sanayisinde üretilen hidrokarbonlar gibi çokatomlu karmaşık gazlara kadar değişen çok çeşitli yapılarda bulunur. Termodinamik bilimi, sınırlı sayıda veri temelinde, gazların davranışlarına ilişkin genel kuralları verir. Gazların en kolay ölçülebilen özellikleri olan basınçları, hacimleri ve sıcaklıkları arasındaki bağıntı oldukça önemlidir. 1662de İngiliz kimyacı Robert Böyle un deneysel olarak geliştirdiği ilk gaz yasasına göre (bak. Boyle-Mariotte yasası), sabit sıcaklıkta, belirli bir miktardaki gazın basıncı (P), hacmiyle (V) ters orantılı olarak değişir. Bu bağıntı, k\ (gazın miktarına ve basıncı ile hacminin birimlerine bağlı olarak seçilen) bir sabit olmak üzere, PV-k\ biçiminde ifade edilir. 1787de Fransız fizikçi Jacques-Alexandre-Cesar Charles, gazların ısıl genleşmeşine ilişkin kendi adıyla anılan ikinci gaz yasasını geliştirdi; aynı yasayı daha sonraları Joseph-Louis Gay- Lussac da ortaya koydu. Bu yasa, sabit basınç altında, belirli miktardaki bir gazın kapladığı hacmin (V), mutlak sıcaklığıyla (T) doğru orantılı olarak değiştiğini belirtir ve deneyle belirlenen bir sabit olmak üzere, VIT=kı biçiminde ifade edilir. Böyle ve Charles yasalarından tek bir eşitlik türetilebilir: Bir gazın basıncı ile hacminin çarpımı, mutlak sıcaklığı ile evrensel gaz sabitinin (R) çarpımına eşittir. Bu eşitlik, P basınç, T mutlak sıcaklık ve V bir mol gazın hacmi olmak üzere, PV=RT biçiminde yazılır.Mol,
bir maddenin, gram ağırlığı ile molekül ağırlığının sayısal olarak eşit olduğu miktarıdır; örneğin, oksijenin (O2) molekül ağırlığı 32 olduğundan bir mol oksijenin ağırlığı da 32 grdir. Evrensel gaz sabiti P, 1,987 kalori/mol-derecedir. 1848de İngiliz fizikçi William Thomson (sonradan Lord Kelvin), mutlak sıcaklık ölçeğini geliştirdi. Charles, 1°C soğutulduklarında gazların hacminin 1/273 oranında daraldığını önceden bulmuştu. Kelvin herhangi bir gazın 273°Cye kadar soğutulduğunda, moleküllerinin enerjisinin sıfıra düşeceğini ortaya koydu. Böylece bu sıcaklığı mutlak sıfır olarak alan mutlak sıcaklık ölçeğini kurdu. Bu ölçekteki 1 derece, Celsius sıcaklık ölçeğindeki 1 dereceye karşılık gelir.Durum denklemi olarak adlandırılan yukardaki bağıntı her koşulda tüm gazlara uygulanamaz; bu nedenle bu bağıntıya tüm koşullarda uyan bir ideal gaz tanımı geliştirilmiştir. İdeal gaz ile herhangi bir gerçek gaz arasında, bir dizi etmenden kaynaklanan çeşitli farklılıklar vardır. İdeal gazda, gaz moleküllerinin fiziksel hacimleri ve kabın içindeki moleküllerin toplam hacmi; atomlar ile moleküllerin birbirleri üzerinde uyguladıkları kuvvetler; yoğunlaşma sırasında ortaya çıkan gizli ısı olgusu; moleküllerin farklı biçimlerde bulunması ve bu farklı biçimlerin molekül çarpışmaları üzerindeki etkisi gibi bir dizi etmen, ısıl durum denkleminde hesaba katılmaz.
Gerçek gazların ısıl durum denklemlerinin belirlenmesine yönelik ilk önemli çalışmayı 1873te HollandalI fizikçi Johannes Diederik van der Waals gerçekleştirdi. Van der Waals, biri moleküllerin hacimlerine, öteki de bunların arasındaki çekim kuvvetine karşılık gelen ve değerleri her gaz için değişik olan iki parametre içeren bir durum denklemi geliştirdi. Van der Waalsın adıyla anılan ve n mol sayısı olmak üzere (P+a/V2) (V-b)=nRT biçiminde ifade edilen bu denklemde a ve b parametreleri, laboratuvarda ölçülen deneysel basınç, hacim ve sıcaklık değerlerinin, parametrelere değişik değerler verilerek denklemden elde edilen kuramsal değerlerle karşılaştırılması yoluyla bulunur.
Herhangi bir gerçek gazdaki moleküller, kuvvet alanlarıyla çevrelenmiş durumdadır; bu nedenle birbirlerinden uzak durumda olsalar da karşılıklı etkileşim içindedirler. Parçacıklar arasındaki bu kuvvetler, gerçek gaz davranışına yol açan başlıca etmendir ve tüm ısıl durum denklemlerinde hesaba katılmak durumundadır. Günümüzde, bir dizi gaz için, yüzün üzerinde deneysel ısıl durum denklemi kurulmuştur. Bunlardan en yaygın kullanılanlarından biri beş, öteki sekiz parametre içermektedir.
Basınç,
hacim ve sıcaklığının yanı sıra herhangi bir gazın bir başka önemli termodinamik özelliğide enerjisidir, Sıcaklığı sabit tutulan bir gazın hacminin değiştirilmesiyle enerjisinde ortaya çıkan değişiklik, aynı ısıl durum denkleminden yararlanılarak bulunabilir. Bir gazın enerjisi ile sıcaklığı arasındaki bağıntı, gazın ısı sığası olarak adlandırılır ve sabit hacim ya da sabit basınçta, deneysel olarak belirlenir. Durum denklemi ve ısı sığası bilinen bir gazın öteki termodinamik özelliklerinin çoğu, başka bir ölçüme gerek kalmaksızın bulunabilir.Bu ilkelerin bulunması yüzyıllar boyunca sürdürülen çalışmaların sonucunda gerçekleşti. 1620de İngiliz filozof Francis Bacon, ısının, o dönemde herkesin sandığı gibi yok edilemez bir akışkan (kalorik) değil, parçacıkların bir hareket biçimi olduğu varsayımını ileri sürdü. Böyle ve Charles ısıl durum denklemini geliştirirken, İngiliz kimyacı Joseph Black 1770te, gaz kalorimetrisi üzerine yaptığı çalışmalar sırasında ısı sığası ve enerji düşüncesini ortaya attı. 1798de ABDli fizikçi Benjamin Thompson ve 1845te İngiliz fizikçi James Prescott Joule, ısının kalorik kuramının geçersizliğini kanıtladılar. Bu özellikleri birbiriyle ilişkilendiren termodinamik yasaları 19. yüzyıl içinde bulundu ve formülleştirildi.
Oksijen ve azot gibi bazı gazlar, oda sıcaklığında, üzerlerindeki basınç ne kadar artırılırsa artırılsın hiçbir zaman sıvı halde yoğunlaşmazlar. Öte yandan oda sıcaklığında tutulan birçok gaz üzerlerindeki basınç artırıldıkça sıvı halde yoğunlaşmaya başlar. Yoğunlaşma sırasında, gazın tamamı sıvıya dönüşüne kadar, gaz ile sıvı karışımının hacmi azalırken basınç ve sıcaklık sabit kalır. Ardından basınç bir miktar daha artırılırsa (gene sabit sıcaklıkta) sıvının hacmi biraz daha azalır. Ayrıca, gaz yoğunlaştıkça, sıcaklığı sabit kalmakla birlikte enerji açığa çıkarır. İngiliz kimyacı ve fizikçi Joseph Blackin 1757de su buharının yoğunlaştırılması üzerine yaptığı çalışmalar sırasında bulduğu bu olguya, yoğunlaşma gizli ısısı denir.
Belirli bir gazı, sabit sıcaklıkta sıkıştırarak sıvılaştırmak için gerekli olan koşulları, 1869da İrlandalı fiziksel kimyacı Thomas Andrews belirledi. Andrews, bir kritik sıcaklık eğrisi oluşturdu. Bu eğri üzerinde, gaz ve sıvı fazlar arasındaki görünür ayrımı tanımlayan noktaya kritik nokta denir. Sıkıştırılan gazın sıcaklığı bu kritik sıcaklıktan yüksek olduğunda, sıkıştırma işlemi gazı sıvılaştırmaz. Gaz kritik noktanın altındaki sabit bir sıcaklıkta sıkıştınldığında ise her zaman yoğunlaşma oluşur. Ayrıca, gaz sıkıştırılırken, sıcaklığı kritik noktanın hemen altında tutulursa yoğunlaşma sırasındaki hacim değişikliği küçük olur. Ancak tam kritik sıcaklıkta sıkıştırılırsa, hacimde hiçbir değişiklik olmadan gaz doğrudan sıvı hale geçer.
Parçacık tanımı.
Termodinamik, gazların birçok fiziksel ve kimyasal özellikleri arasındaki ilişkileri belirlemek açısından çok genel ve güçlü bir disiplin olmakla birlikte, bu özelliklerin gerçek sayısal değerlerini saptamak oldukça zordur. Bu tür değerlerin hesaplanabilmesi için, tüm gazların tek atomlu ya da karmaşık çok atomlu moleküllerden oluştuğu kabulüne dayalı bir mikroskopik kurama gereksinim vardır. Gazların parçacık tanımı, 17. ve 18. yüzyıllarda, çevresinde herhangi bir güç alanı bulunmadığı kabul edilen yapışız gaz parçacıklarının toplu davranışlarının açıklanmasına yönelik çalışmalarla geliştirilmeye başladı. Bu tür bir gazın, içinde bulunduğu kabın duvarlarına uyguladığı basınç hesaplandı ve sıcaklığın parçacık devinimine bağlı olduğu düşüncesi geliştirildi. 19. yüzyılda sabit hacimde tutulan bir gazın ısı sığası hesaplandı ve elde edilen değerin deneysel olarak ölçülen değerlerle uyuşmadığı görüldü. Aynı gazın sabit basınç altındaki ısı sığası hesaplandığında ise, deneysel değerlerle uyumun bulunduğu saptandı. İki ısı sığasının birbirine oranı da hesaplandı ve gaz parçacıklarının belirli bir iç yapıya ve aynı zamanda moleküler dönme ve titreşim gibi iç enerji modlarına (kip) sahip olduğu düşüncesi ortaya atıldı.Ardından ortalama serbest yol ve ikili çarpışma kavramları geliştirildi. 1859da Ingiliz fizikçi James Clerk Maxwell ve 1868de AvusturyalI fizikçi Ludvvig Eduard Boltzmann, seyreltik (basıncı düşük) bir gazın tekparçacık dağılım fonksiyonunun hesaplanmasına yönelik ilk matematiksel çalışmaları başlattılar (bak. Maxwell-Boltz- mann dağılım yasası). Maxwell ve Boltz- mannın gazların kinetik kuramına ilişkin bu çalışmaları, yapışız parçacıklardan oluşan ve termodinamik denge durumunda bulunan seyreltik gazların, klasik (Newtoncu) istatistiksel termodinamik kuramının geliştirilmesini olanaklı kıldı. İdeal olmayan, yani parçacıkları kuvvet alanlarıyla çevrelenmiş gerçek gaz düşüncesi Newtona dayanır. Bu tür parçacıkların ilk doğru inceleme girişimleri 18. yüzyılda başladı ve van der Waals 1873te gerçek bir gazın durum denklemini geliştirdi. Alman fizikçi Rudolf Calsius ise 1875te, moleküller arası kuvvetler ile ısıl durum denklemi arasındaki bağıntıya ilişkin bir teorem kurdu. 1901de ABDli fizikçi J. Willar Gibbs, klasik Newtoncu mekanikten yararlanarak, gerçek gazlar için genel bir istatistiksel termodinamik kuram geliştirdi. Bundan bir yıl önce Alman fizikçi Max Planck, enerjinin kuvan- talaşmasım bulmuştu; ama gerçek gazların kuvantum istatistiksel termodinamiğini 1924te, birbirlerinden habersiz olarak Hintli fizikçi Satyendra Nath Bose ve Albert Einstein ile 1926da Enrico Fermi ve Paul A. M. Dirac kurdular.
Herhangi bir kap içindeki bir gaz milyarlarca parçacıktan oluşur. Örneğin standart koşullarda, bir metreküp hava KPten daha çok sayıda parçacık içerir. Bu parçacıkların her biri kap içinde rasgele hareket eder ve parçacığın ısıl enerjisi arttıkça hareket hızı da artar. Atmosfer yoğunluğuna yakın yoğunluklardaki gazlarda, tüm parçacıklar ısıl hız denen sabit bir hızla hareket eder. Herhangi bir anda, yaklaşık 100 bin parçacıktan biri, bir başka parçacıkla ya da kabın duvarlarıyla çarpışır ve bir saniyelik bir zaman aralığında gazın her parçacığı yaklaşık bir milyar kez çarpışır, iki parçacık arasında gerçekleşen bir çarpışma sonucunda her iki parçacık da hızları ile hareket yönlerini değiştirebilir. Bu tür bir ikili çarpışmada, gaz tek atomlu parçacıklardan oluşmuşsa, çarpışan çiftlerin kütlesi, momentumu ve ısıl kinetik enerjisi sabit kalır ve bu çarpışmaya esnek ikili çarpışma denir. Parçacıklar çok atomlu moleküller içeriyorsa, esnek olmayan ikili çarpışma oluşur ve kütle ile momentum sabit kalmakla birlikte çarpışan çiftin ısıl kinetik enerjisinin bir bölümü moleküllerin iç enerjisine dönüşür. Gazın yoğunluğu atmosfer yoğunluğunun üzerinde ise, üç ya da dört parçacık ve daha yoğun gazlardada, daha fazla parçacık tek bir çarpışmada bir araya gelebilir.
Bir gaz içeren kabın rasgele seçilmiş çok küçük bir bölgesindeki parçacık sayısı ile rasgele seçilmiş oldukça dar bir hız aralığında yer alan ısıl hızlar, dağılım fonksiyonu denilen matematiksel bir denklemle ifade edilir. Gaz üzerine dışarıdan bir kuvvet etkimediğinde, dağılım fonksiyonu parçacıkların konumu ile zamandan bağımsız bir değere ulaşır. Bu değer, gazın bir termodinamik denge durumuna eriştiğini gösterir. Termodinamik denge durumunda gazın basıncı, yoğunluğu, sıcaklığı, enerjisi, ısı sığası ve entropisi sabittir. Ayrıca basınç, sıcaklık ve yoğunluk, gazın hacminin tamamında aynı değerlerdedir.
Kaynak:AnaBritannica
Son düzenleyen perlina; 16 Aralık 2016 17:44
Sebep: İçerik.
Şeytan Yaşamak İçin Her Şeyi Yapar....

 Maddenin Gaz Hali
Maddenin Gaz Hali