Ziyaretçi
Bir metal atomu veya iyonu etrafına kümelenmiş olan ligandların oluşturduğu yapılara koordinasyon bileşikleri denir. Koordinasyon bileşiklerinin çoğu renkli, paramanyetik, katalitik özelliğe sahip ve birden fazla yükseltgenme basamağına sahiptir.
Elektron çifti içeren iyon veya moleküllere ligand denir.
Koordinasyon bileşikleri genel olarak [MLn]+x,-y olarak gösterilebilir.
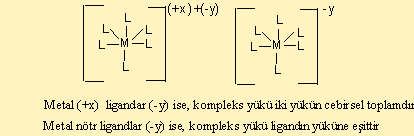
1) Oluşan bileşik nötr, pozitif veya negatif yüklü olabilir.
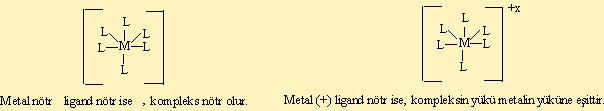
2) Kompleks oluşumlarında renk değişikliği gözlenir. Örneğin:
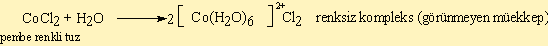
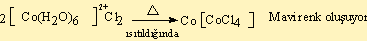
3) İletkenlikleri farklıdır.
Werner teorisine göre her elementin 2 tip değerliği vardır. Bunlar
a) Birincil değerlik ( yükseltgenme basamağı)
b) İkincil değerlik (koordinasyon sayısı)
Her element birincil ve ikincil değerliliğini doyurmak ister. İkincil değerliğin uzayda belirli bir yönlenmesi vardır.
CoCl3.6NH3
Kobaltın ligandlar tarafından aşağıdaki şekilde sarıldığı ve klorların daha uzak pozisyonlarda yerleştiği ileri sürülür.
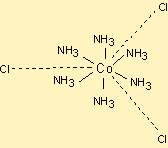
Bu kompleks AgNO3 ile tepkimeye sokulursa ve iletkenliği ölçülürse 4 iyon iletkenliği ölçülür.
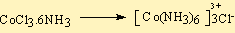
CoCl3.5NH3 örneği incelenecek olursa aşağıdaki şekilde ligandlar ile tarafından sarıldığı görülmüştür.
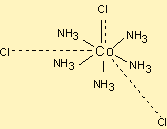
Bu kompleks AgNO3 ile tepkimeye sokulursa ve iletkenliği ölçülürse3 iyon iletkenliği ölçülür.
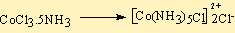
Burada 2 tane klor koordinasyon küresinin dışındadır ve AgNO3 ile AgCl şeklinde çöker.
Sonuçta iletkenlik iyon sayısı ile doğru orantılı olduğu için CoCl3.6NH3 daha iletkendir.
Ders notlarını bizlerle paylaştığı için Gazi Üniversitesi Kimya Bölümü Öğretim Üyesi Sayın Prof. Dr. Nurcan Karacan hocamıza teşekkür ederiz.
Elektron çifti içeren iyon veya moleküllere ligand denir.
Sponsorlu Bağlantılar
Koordinasyon bileşikleri genel olarak [MLn]+x,-y olarak gösterilebilir.
1) Oluşan bileşik nötr, pozitif veya negatif yüklü olabilir.
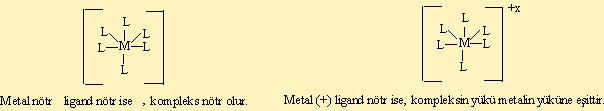

2) Kompleks oluşumlarında renk değişikliği gözlenir. Örneğin:
- CoCl3.6NH3 sarı
- CoCl3.5NH3 mor
- CoCl3.4NH3 yeşil
- CoCl3.5NH3.H2O kırmızı
- IrCl3.6NH3 beyaz
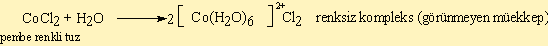
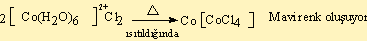
3) İletkenlikleri farklıdır.
Werner teorisine göre her elementin 2 tip değerliği vardır. Bunlar
a) Birincil değerlik ( yükseltgenme basamağı)
b) İkincil değerlik (koordinasyon sayısı)
Her element birincil ve ikincil değerliliğini doyurmak ister. İkincil değerliğin uzayda belirli bir yönlenmesi vardır.
CoCl3.6NH3
Kobaltın ligandlar tarafından aşağıdaki şekilde sarıldığı ve klorların daha uzak pozisyonlarda yerleştiği ileri sürülür.

Bu kompleks AgNO3 ile tepkimeye sokulursa ve iletkenliği ölçülürse 4 iyon iletkenliği ölçülür.
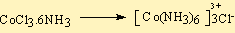
CoCl3.5NH3 örneği incelenecek olursa aşağıdaki şekilde ligandlar ile tarafından sarıldığı görülmüştür.

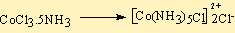
Burada 2 tane klor koordinasyon küresinin dışındadır ve AgNO3 ile AgCl şeklinde çöker.
Sonuçta iletkenlik iyon sayısı ile doğru orantılı olduğu için CoCl3.6NH3 daha iletkendir.
Ders notlarını bizlerle paylaştığı için Gazi Üniversitesi Kimya Bölümü Öğretim Üyesi Sayın Prof. Dr. Nurcan Karacan hocamıza teşekkür ederiz.
Son düzenleyen asla_asla_deme; 28 Mayıs 2012 14:55
Sebep: Resim Linkleri Yenilendi

 Koordinasyon Kimyası
Koordinasyon Kimyası
