Lityum (Li)

periyodik tablonun la grubunda (alkali metaller grubu) yer alan kimyasal element.
Sponsorlu Bağlantılar
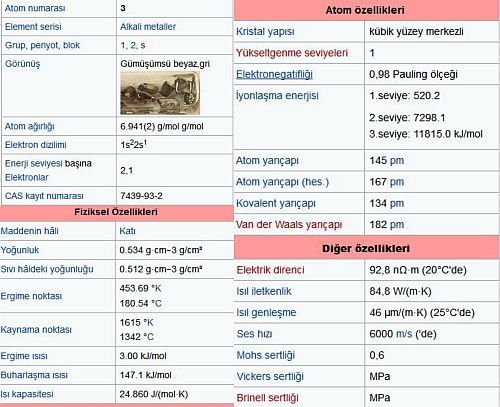
Katı haldeki elementlerin en hafifi olan lityumun yumuşak, beyaz renkli ve parlak olan metali ile çeşitli alaşımları ve bileşikleri sanayi çapında üretilmektedir.
Bulunduğu yerler, kullanım alanları ve özellikleri.
Lityumu ilk olarak 1817de Johan August Arfwedson petalit mineralinde buldu. Lityum aynca spodümen, lepidolit, ambligonit ve trifilit gibi minerallerde ekonomik olarak üretilebilecek miktarlarda bulunur ve yerkabuğunun yaklaşık yüzde 0,002sini oluşturur. Lityum bu minerallerin kimyasal yollarla işlenmesi sonucunda lityum hidroksit, karbonat ya da sülfat halinde elde edilir. Lityum metali erimiş lityum ve potasyum klorür karışımının elektroliziyle hazırlanır. Tel olarak çekilebilen, haddelenerek levha haline getirilebilen lityum metali kurşundan daha yumuşak olmakla birlikte öbür alkali metallerden daha serttir. Metalin kristal yapısı gövde (hacim) merkezli kübiktir. Lityum ve lityum bileşikleri aleve koyu kırmızı bir renk verir. Lityum su üstünde yüzer, suyla tepkimeye girerek lityum hidroksit (LiOH) oluşturur ve hidrojen gazı açığa çıkarır. Havadaki nemle de tepkimeye girdiğinden, çoğunlukla vazelinle kaplanmış olarak saklanır.
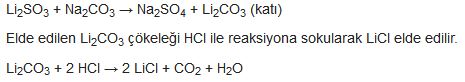
Lityum doğada
lityum-7 (yüzde 92,5) ve lityum-6 (yüzde 7,5) izotoplarının karışımı halinde bulunur. Aynca lityumun üç radyoaktif izotopu hazırlanmıştır. Bunlar yan ömürleri 1 saniyeden daha kısa olan lityum- 5, lityum-8 ve lityum-9dur. 1932de John Cockcroft ve Ernest Walton, yapay olarak hızlandınlmış atom parçacıklanyla çekirdeğin dönüştürülmesi çalışmalannda hedef metal olarak lityumdan yararlandılar ve her lityum çekirdeği bir proton soğurarak iki helyum çekirdeği oluşturdu. Lityum-6nın yavaş nötronlarla bombardımanıyla da helyum ve trityum ortaya çıkar.
Alüminyum, kurşun ve öbür yumuşak metaller az miktarda lityumla alaşımlanarak sertleştirilebilir.
Bileşikleri
Lityum tepkin bir maddedir. Üç elektronundan birini kolaylıkla vererek Li+ katyonu içeren bileşikler oluşturur. Bu bileşiklerin çoğunun çözünürlükleri öbür alkali metallerin ilgili bileşiklerinkinden çok farklıdır. Lityum bileşiklerinden yaygın olarak yararlanılır. Beyaz renkli kristal yapılı bir katı olan lityum hidrür (LiH), lityum ve hidrojenin doğrudan birleşmesiyle oluşur ve suyla işlem gördüğünde hemen hidrojen gazı açığa çıkanr; bu özelliği nedeniyle de hidrojen kaynağı olarak yararlanılır. Lityum hidrür aynca aldehitleri, ketonlan ve karboksilli esterleri hızla alkollere indirgeyen lityum alüminyum hidrür (LİAIH4) üretiminde de kullanılır.
Lityum hidroksit (LiOH) çoğunlukla lityum karbonatın kireçle tepkimeye sokulmasıyla elde edilir ve stearik asidin ve öbür yağ asitlerinin lityum tuzlannın (sabunlar) üretiminde kullanılır. Bu sabunlar gres yağlanna kalınlaştıncı olarak katılır. Lityum hidroksit aynca bazik pillerdeki elektrolitlerde katkı maddesi olarak ve karbon dioksit soğurucusu olarak da kullanılır. Lityum klorür (LiCl) ve lityum bromür (LiBr) sanayi açısından çok önemli öbür lityum bileşikleridir. Bu bileşikler çok geniş bir sıcaklık aralığında havanın nemini soğurabilen derişik tuzlu çözeltiler oluşturur. Bu çözeltiler büyük soğutucularda ve klimalarda yaygın olarak kullanılır. Lityum flüorürden (LİF) başlıca emaye ve camlardan eritme maddesi olarak yararlanılır. Lityumun en önemli bileşiği lityum karbonattır (Lİ2CO3). Bu bileşik öbür lityum bileşiklerinin üretiminde kullanılır; ayrıca, manik-depresif psikoz tedavisinde de etkindir.
Lityum atomunun Li+ iyonu halinde bulunmadığı ve doğrudan bir karbon atomuna bağlı olduğu organolityum bileşiklerinden öbür organik bileşiklerin yapımında yararlanılır. Yapay kauçuk üretiminde kullanılan bütillityum (C4H9Lİ), bütil bromürün lityum metaliyle tepkimeye sokulmasıyla elde edilir.
kaynak: Ana Britannica
BAKINIZBileşikler - Lityum Florür (Lif Bileşiği)
Bileşikler - Lityum Karbonat
Son düzenleyen Safi; 21 Mart 2017 21:05

 Elementler - Lityum
Elementler - Lityum