Aminoasitler
Proteinlerin temel yapı taşı aminoasitlerdir. Bugüne kadar belirlenmiş 20 aminoasit bulunmaktadır. Aminoasitler dallanmış yapıda hidrokarbon zincirleridir. Aminoasitler birbirlerine peptid bağlarıyla bağlanarak peptidleri oluşturur. Peptidler ise proteinleri meydana getirir.
Proteinler kaynaklarına göre farklı aminoasitleri farklı miktarlarda içerirler. İnsan vücudunda yaklaşık 20 farklı aminoasit bulunmaktadır (Tablo) veyetişkinlerde 8 çocuklarda 10 tanesi dışında organizma bunların hepsini sentezleyebilir. Sentezlenemeyen 8 aminoasite elzem aminoasitler denir ve mutlaka gıdalarla dışardan alınarak karşılanmalıdır . Bu aminoasitler lizin, alanin, valin, lösin, izolösin, metionin, threonin, triptofan ve fenilalanindir.Çocuklarda bunlara ek olarak arjinin ve histidinnide sayabiliriz.
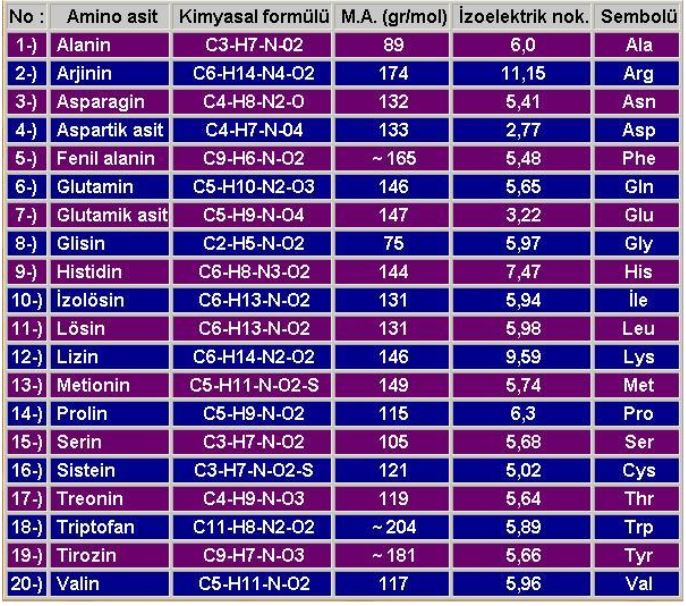 Aminoasitlerin Yapısı
Aminoasitlerin Yapısı
Aminoasit molekülleri, bir ucunda "amino grubu ( NH2 ) " diğer ucunda ise "karboksil ( COOH )" grubu taşırlar. Aminoasitlerin yan yana gelip zincirler oluşturarak proteinleri sentezlemesi, bu iki grubun aralarında kovalent veya iyonik bağ yapmasıyla gerçekleşir. İki aminoasit yan yana geldiğinde COOH ve NH2 grupları arasında bağlanma meydana gelir ve bu bağa "peptid bağı" adı verilir. Bağlanma sırasında ise bir su molekülü sebest kalır. İki aminoasidin yanlızca uç kısımlarını yani karboksil ve amino gruplarının bağlanması şu şekilde olur.
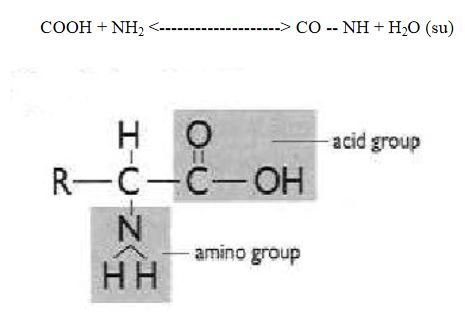
Denklemde COOH birinci aminoasidin bir ucu, NH2 ise ikinci aminoasidin diğer ucunu temsil etmektedir. Bu uçlar yan yana geldiklerinde COOH grubundan bir oksijen ve NH2 grubundan bir hidrojen serbest kalır. Böylelikle serbest kalan bu atomlar aralarında bağ yaparak suyu oluşturur. İki aminoasidin yan yana gelmesiyle oluşan peptid bağına "dipeptid", üç veya daha fazla (yüzlerce ya da binlerce) aminoasidin yan yana gelmesiyle oluşan zincirdeki peptid bağlarına ise "polipeptid" adı verilir. Proteinler düz aminoasit zincirlerinden meydana gelmesine rağmen oldukça karmaşık yapılara sahiptir. Bunun nedeni ise zincirdeki bazı aminoasitlerin birbirleriyle ikinci veya üçüncü bir bağ yapmasındandır.
Aminoasitlerin net yük, çözünürlük, kimyasal reaktiflik, hidrojen bağlama gücü gibi bazı fizikokimyasal özellikleri R grubunun ( çeşitli aminoasitleri meydana getiren değişken grup)kimyasal doğasına bağlıdır. Genellikle proteinlerde büyüklük, şekil, yük, hidrojen bağlama yeteneği ve kimyasal etkileşimde farklı 20 çeşit yan zincir ( R grubu ) bulunur. Proteinler aracılığı ile yürütülen işlevlerin çok olması genelde bu 20 yapı taşının yani aminoasidin farklı sayıda ve düzende sırlanmasındadır.
Aminoasitlerin Fiziksel ve Kimyasal Özellikleri İyonik özellikler (Dissosiyasyon, izoelektrik nokta)
Aminoasitlerinin yapısında bulunan amino (-NH2) ve karboksil (-COOH) grupları sulu çözeltilerinin asidik, bazik ya da amfoter karakter ( bileşiğin hem asit hem de baz özelliği taşıması yani asidik ortamda baz, bazik ortamda asit gibi davranması ) kazanmalarına neden olur. Çözeltinin amfoter özellik gösterdiği pHya izoelektrik nokta denir ve her aminoasit için spesifik bir değerdir. Bu özelliğinden dolayı elektroforez denilen aletle kolayca birbirinden ayrılırlar ve miktarları da belirlenebilir.
Çözünürlük
Aminoasitler tuz benzeri yapıları nedeniyle kararlı, kristal yapıdadır ve genellikle suda çözünürler. Polar karakterleri nedeniyle alkollerdeki çözünürlükleri güç olup diğer organik çözücülerde de (eter vb) çözünememektedirler. Etil alkoldeki çözünürlük derecesi aminoasit çeşidine bağlı olarak değişmektedir. Aminoasitlerin alkoldeki çözünürlüğünün düşük olması, aminoasitlerin polar karakterlerinden kaynaklanmaktadır.
Ortama asit ya da baz ilavesi ortamda tuz oluşumu sağlayarak çözünürlüğü artırmaktadır. Diğer aminoasitlerin ortamda bulunuşu da çözünürlüğü teşvik eder.
UV absorbsiyonu
Aminoasitlerin maksimum UV absorbsiyonunu ve floresans özelliğini farklı dalga boylarında gösterir. Proteinlerdeki yapısal değişimler, bu aminoasitler üzerinden gözlenen absorbans ve floresans değişimleri takip edilerek belirlenebilmektedir.
Optik aktivite
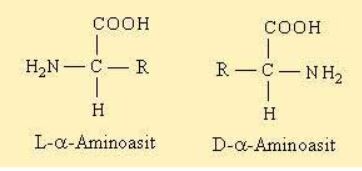
Glisin dışındaki tüm aminoasitlerin karbon atomu asimetriktir, yani dört farklı grup bağlanmıştır. Bu da optikçe aktif olmalarına neden olur. Bunlar polarize ışığın yönünü değiştirme yeteneğinde olan maddelerdir. Yön değiştirme sola veye sağa olabilir. Doğal aminoasitler L formunda bulunur ve D-aminoasitler atipik aminoasitlerdir. Bazı bakterilerin hücre duvarları ile antibiyotiklerin yapısında bulunurlar. Polarize ışığı sağa çevirenler +, dekstrorotary, sola çevirenler -, levorotary olarak bilinirler. Doğal aminoasitlerin çoğu polarize ışığı sağa çevirir. D- amino asitlerin çoğunluğu ise vücut tarafından kullanılamaz. Bu nedenle de bunlara doğal olmayan aminoasitler de denir.
DEVAMI Proteinler ve Beslenmedeki Önemi