PROTEİNLER
Proteinler büyük moleküllü maddelerdir, molekül ağırlıkları birkaç bin ile milyonlar arasında değişir .
Protein kelimesi eski Yunancada ilk önce gelen, birinci sıradan anlamındaki proteois kelimesinden kaynaklanmıştır. Latincedeki karşılığı yaşayan varlıklar için elzem azotlu öğedir.
Proteinler temelde % 50-55 karbon, % 6-7 hidrojen, % 20-23 oksijen, % 12-19 azot ve %0.2-3.0 kükürt içeren ve yalnızca ribozomlarda sentezlenen bileşiklerdir. Bazı proteinlerde bunlardan başka P, Fe, Zn, Cu gibi elementler de bulunabilmektedir. Değişik proteinler, değişik sayı ve çeşitte aminoasit içerirler . Yapıyı oluşturan aminoasitler birbirlerine peptid bağlarıyla bağlandıklarından polipeptid yapısına sahiptir. Proteinler bir tek polipeptidden meydana geldikleri gibi birkaç polipeptidin bir araya gelmesiyle de oluşabilir. Her bir polipeptid zinciri ya da genel olarak protein, belli bir aminoasit sayısına, dizgilenmesine, belirli bir molekül ağırlığına, kimyasal içeriğe ve üç boyutlu bir yapıya sahiptir. Bazı proteinler aminoasitlerin yanı sıra karbonhidrat, lipid, mineral madde ve renk maddeleri (pigmentler) gibi diğer yapıtaşlarını da içerir.
Her canlı kendine özgü proteinler taşımaktadır. Bu bakımdan bir canlıdaki protein o canlı için tekdir. Proteinlerin karbonhidrat ve lipitlerden ayrıcalıkları bu özellikten kaynaklanmaktadır. Örneğin; çok karmaşık bir yapıya sahip olsa da bütün canlılardaki karbonhidratların ve lipitlerin yapısı aynıdır.
Bitkiler kendi proteinlerini kök ve yapraklardan emilen inorganik kaynaklardan (CO2, su ve azot) sentezleme yeteneğine sahiptir. Bitkiler bu sentez olayında inorganik azot kaynaklarını kullanabildikleri halde, insan ve diğer yüksek hayvanlar kendi vücut proteinlerinin sentezini gerçekleştirebilmek için gerekli azot kaynağını diyetteki bitkisel ve hayvansal proteinlerden sağlamak zorundadırlar. Diğer taraftan havanın serbest azotunu yalnızca belirli bazı mikroorganizmalar tespit etme yeteneğine sahiptir.
Sonuç olarak, insan gereksinim duyduğu proteini bitkisel ve hayvansal gıdalardan sağlamakta ve bu kaynakların tüketimiyle insan vücuduna diğer proteinler, sindirim sonucu aminoasitlere kadar indirgenmektedir. İnsan vücudu, bu aminoasitleri genlerin (DNA -Deoksiribo nükleik asit) denetiminde, belirli bir diziliş sırasında birleştirerek kendine özgü proteinlerini elde ederek kullanmaktadır.
Aminoasitler
Proteinlerin temel yapı taşı aminoasitlerdir. Bugüne kadar belirlenmiş 20 aminoasit bulunmaktadır. Aminoasitler dallanmış yapıda hidrokarbon zincirleridir. Aminoasitler birbirlerine peptid bağlarıyla bağlanarak peptidleri oluşturur. Peptidler ise proteinleri meydana getirir.
Proteinler kaynaklarına göre farklı aminoasitleri farklı miktarlarda içerirler. İnsan vücudunda yaklaşık 20 farklı aminoasit bulunmaktadır (Tablo) veyetişkinlerde 8 çocuklarda 10 tanesi dışında organizma bunların hepsini sentezleyebilir. Sentezlenemeyen 8 aminoasite elzem aminoasitler denir ve mutlaka gıdalarla dışardan alınarak karşılanmalıdır . Bu aminoasitler lizin, alanin, valin, lösin, izolösin, metionin, threonin, triptofan ve fenilalanindir.Çocuklarda bunlara ek olarak arjinin ve histidinnide sayabiliriz.
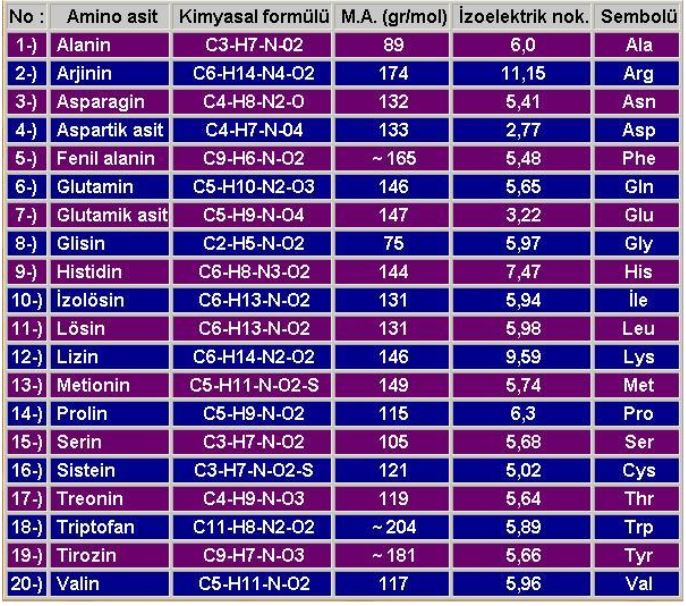
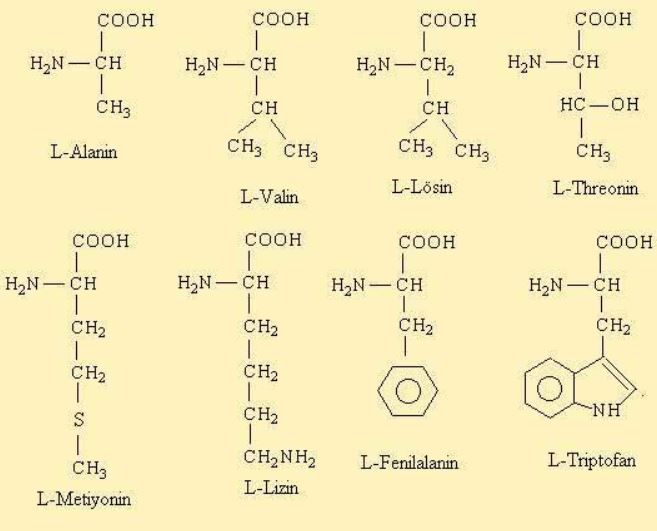
Aminoasitlerin Yapısı
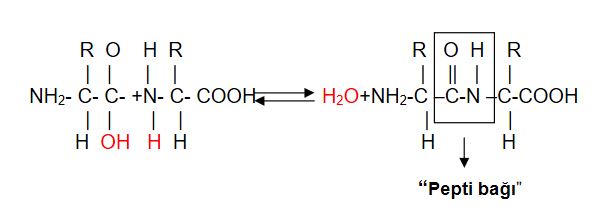
Aminoasit molekülleri, bir ucunda "amino grubu ( NH2 ) " diğer ucunda ise "karboksil ( COOH )" grubu taşırlar. Aminoasitlerin yan yana gelip zincirler oluşturarak proteinleri sentezlemesi, bu iki grubun aralarında kovalent veya iyonik bağ yapmasıyla gerçekleşir. İki aminoasit yan yana geldiğinde COOH ve NH2 grupları arasında bağlanma meydana gelir ve bu bağa "peptid bağı" adı verilir. Bağlanma sırasında ise bir su molekülü sebest kalır. İki aminoasidin yanlızca uç kısımlarını yani karboksil ve amino gruplarının bağlanması şu şekilde olur.
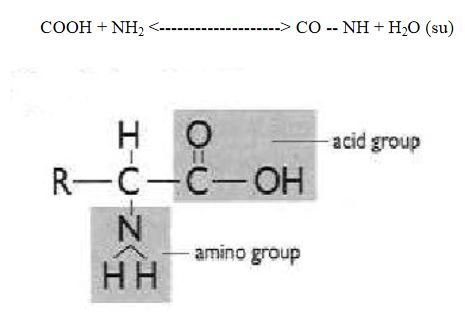
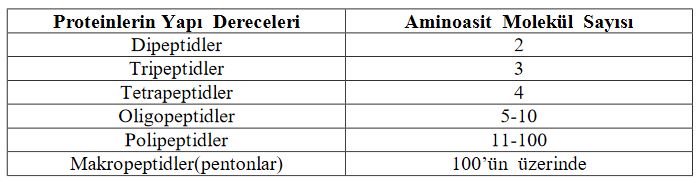
Denklemde COOH birinci aminoasidin bir ucu, NH2 ise ikinci aminoasidin diğer ucunu temsil etmektedir. Bu uçlar yan yana geldiklerinde COOH grubundan bir oksijen ve NH2 grubundan bir hidrojen serbest kalır. Böylelikle serbest kalan bu atomlar aralarında bağ yaparak suyu oluşturur. İki aminoasidin yan yana gelmesiyle oluşan peptid bağına "dipeptid", üç veya daha fazla (yüzlerce ya da binlerce) aminoasidin yan yana gelmesiyle oluşan zincirdeki peptid bağlarına ise "polipeptid" adı verilir. Proteinler düz aminoasit zincirlerinden meydana gelmesine rağmen oldukça karmaşık yapılara sahiptir. Bunun nedeni ise zincirdeki bazı aminoasitlerin birbirleriyle ikinci veya üçüncü bir bağ yapmasındandır.
Aminoasitlerin net yük, çözünürlük, kimyasal reaktiflik, hidrojen bağlama gücü gibi bazı fizikokimyasal özellikleri R grubunun ( çeşitli aminoasitleri meydana getiren değişken grup)kimyasal doğasına bağlıdır. Genellikle proteinlerde büyüklük, şekil, yük, hidrojen bağlama yeteneği ve kimyasal etkileşimde farklı 20 çeşit yan zincir ( R grubu ) bulunur. Proteinler aracılığı ile yürütülen işlevlerin çok olması genelde bu 20 yapı taşının yani aminoasidin farklı sayıda ve düzende sırlanmasındadır.
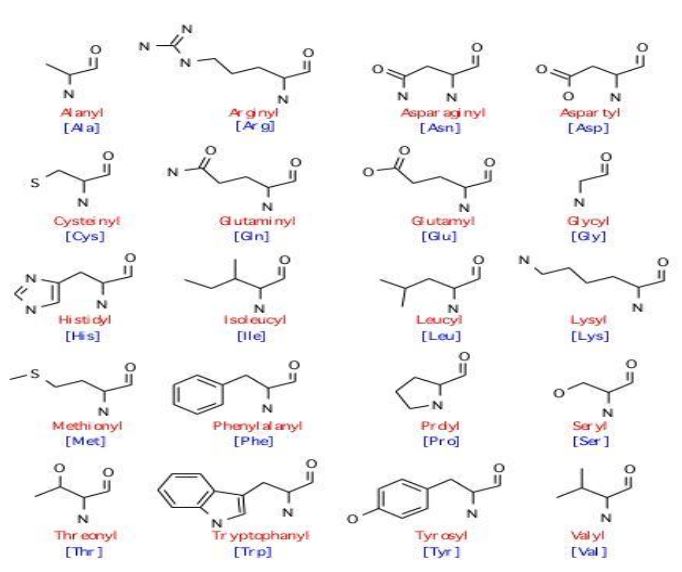
Aminoasitlerin Sınıflandırılması
Alkil kökünün ( R ), düz zincir ( alifatik ) veya halkalı ( aromatik ) yapıda oluşuna göre aşağıdaki gibi 2 sınıfta incelenirler.
- Düz zincirli ( alifatik ) amin asitler: Alkil kökü düz veya dallanmış karbon zincirinden meydana gelmiştir. Bunlar; glisin ( en basit aminoasit ), alanin, valin, lösin, izolösin, aspartik asit, glutamik asit, lizin, hidroksilizin, serin, treonin, sistein ve sistin,mitionin,arginindir.
- Halkalı ( aromatik ) aminoasitler: Karbon atomları halka oluşturacak biçimde bağ yapmıştır. Bunlar; fenilalanin, tirozin, pirolin, hidroksipirolin, histidin, triptofandır.
Yine aminoasitler organizmada sentez edilip edilmediğine göre de 2ye ayrılır.
- Dışardan alınan ( ekzojen ) aminoasitler: Elzem veya esansiyel amino asitler de denir. Vücudumuzda sentezi yapılamaz. Besin maddelerinde yeter miktarda vardır. Organizmadaki azot dengesinin devamı için bu aminoasitlerin besinlerle dışarıdan alınması şarttır. Elzem aminoasitlerin adlarının bir önceki konuda belirtildiğini hatırlayınız.
Aminoasitlerin Fiziksel ve Kimyasal Özellikleri
İyonik özellikler (Dissosiyasyon, izoelektrik nokta)
Aminoasitlerinin yapısında bulunan amino (-NH2) ve karboksil (-COOH) grupları sulu çözeltilerinin asidik, bazik ya da amfoter karakter ( bileşiğin hem asit hem de baz özelliği taşıması yani asidik ortamda baz, bazik ortamda asit gibi davranması ) kazanmalarına neden olur. Çözeltinin amfoter özellik gösterdiği pHya izoelektrik nokta denir ve her aminoasit için spesifik bir değerdir. Bu özelliğinden dolayı elektroforez denilen aletle kolayca birbirinden ayrılırlar ve miktarları da belirlenebilir.
Çözünürlük
Aminoasitler tuz benzeri yapıları nedeniyle kararlı, kristal yapıdadır ve genellikle suda çözünürler. Polar karakterleri nedeniyle alkollerdeki çözünürlükleri güç olup diğer organik çözücülerde de (eter vb) çözünememektedirler. Etil alkoldeki çözünürlük derecesi aminoasit çeşidine bağlı olarak değişmektedir. Aminoasitlerin alkoldeki çözünürlüğünün düşük olması, aminoasitlerin polar karakterlerinden kaynaklanmaktadır.
Ortama asit ya da baz ilavesi ortamda tuz oluşumu sağlayarak çözünürlüğü artırmaktadır. Diğer aminoasitlerin ortamda bulunuşu da çözünürlüğü teşvik eder.
UV absorbsiyonu
Aminoasitlerin maksimum UV absorbsiyonunu ve floresans özelliğini farklı dalga boylarında gösterir. Proteinlerdeki yapısal değişimler, bu aminoasitler üzerinden gözlenen absorbans ve floresans değişimleri takip edilerek belirlenebilmektedir.
Optik aktivite
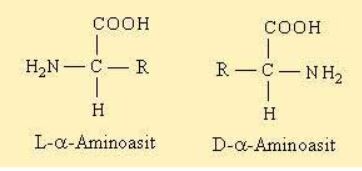
Glisin dışındaki tüm aminoasitlerin karbon atomu asimetriktir, yani dört farklı grup bağlanmıştır. Bu da optikçe aktif olmalarına neden olur. Bunlar polarize ışığın yönünü değiştirme yeteneğinde olan maddelerdir. Yön değiştirme sola veye sağa olabilir. Doğal aminoasitler L formunda bulunur ve D-aminoasitler atipik aminoasitlerdir. Bazı bakterilerin hücre duvarları ile antibiyotiklerin yapısında bulunurlar. Polarize ışığı sağa çevirenler +, dekstrorotary, sola çevirenler -, levorotary olarak bilinirler. Doğal aminoasitlerin çoğu polarize ışığı sağa çevirir. D- amino asitlerin çoğunluğu ise vücut tarafından kullanılamaz. Bu nedenle de bunlara doğal olmayan aminoasitler de denir.
Aminoasitlerin renk reaksiyonları
Aminoasitler ve yapılarında aminoasit bulunan proteinler kimyasal maddelerle renkli reaksiyonlar verir. Bu reaksiyonlardan yararlanarak aminoasitlerin ve proteinlerin kantitatif tayinleri yapılır.
Ninhidrin aminoasitlerin tanınmasında kullanılan önemli bir maddedir. Aminoasitlerin ninhidrin ile kaynatılması ile mavi-menekşe renk oluşur.Bu durum çalışılan örnekte amino asitin varlığını kanıtlar.
PROTEİNLERİN YAPISI VE ÖZELLIKLERI
Proteinlerin Yapısı
Bir aminoasidin karboksil grubu (-COOH) başka bir aminoasidin amino grubuyla (-NH2) bir mol su açığa çıkararak birleşir ve peptid zinciri oluşturur (Şekil 2.1). Peptidler peptid zincirinde yer alan aminoasit sayısına göre mono, di, tri gibi ön ekler verilerek isimlendirilirler. Genel bir kural olarak yapısında 10 kadar aminoasit içeren peptid zincirleri oligopeptid, daha uzun zincirli peptidler ise polipeptid olarak adlandırılır.
Proteinlerin pek çoğu tek bir polipeptid zincirinden oluşur (myoglobin). Bazıları ise birbirlerinin aynı ya da farklı olan iki veya daha fazla polipeptidlerden meydana gelebilir.
Her proteinin karakteristik üç boyutlu doğal bir yapısı vardır. Üç boyutlu yapısı bozulmuş (denatüre olmuş ) bir protein biyolojik etkinliğini de kaybeder. Proteinlerin karakteristik üç boyutlu yapılarını oluşumundan primer, sekonder, tersiyer ve kuarterner olarak adlandırılan yapılar sorumludur. Primer yapı her proteinde yer almakta, buna karşılık bazı proteinler sekonder yapıda bazıları ise tersiyer veya kuarterner yapıda kendilerine özgü üç boyutlu yapılarına kavuşmaktadır.
Primer Yapı (Birincil Yapı )
Bir protein molekülünü oluşturan polipeptid zinciri veya zincirlerindeki aminoasit sıralanışı proteinlerin primer yapısını oluşturur. Daha önce de belirtildiği gibi aminoasitler peptid bağlarıyla birleşerek polipeptidleri oluşturur. Primer yapı proteinlerin üç boyutlu yapısına bir geçiş teşkil eder ve fonsiyonel değildir
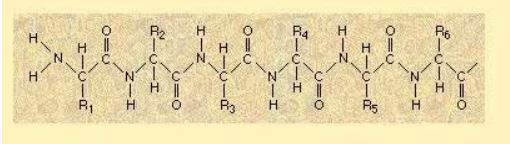
Sekonder Yapı( İkincil Yapı )
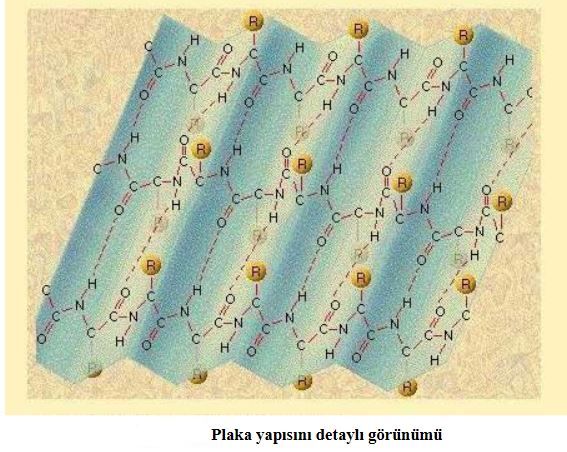
Peptid zinciri üzerinde belirli bölgeler yan zincirlerle ve/veya kendi üzerine katlanarak bağlar oluşturur. Polipeptid zincirindeki bu katlanmalar periyodik olarak tüm zincir boyunca yinelenir. İki elektronegatif atom arasındaki hidrojen bağı polipeptid zincirinde heliksel yapı oluşmasına neden olur. Sekonder proteinler heliksel yapıda ya da plakalı yapıda olabilir. Bu yapılara kararlılık kazandıran aynı polipeptid zinciri üzerinde kurulan H köprüleridir ve en stabil yapı göstereni a-heliks proteinlerdir. a-heliks proteinlerin çoğunda heliksin bir yüzü hidrofobik ( su sevmeyen ) iken diğer yüzü ve yan zincirler hidrofilik (su seven ) kalıntılarla bağlanmıştır.
Plakalı protein yapısı heliksel yapıdan farklı olarak pili benzeri yapı oluşturacak şekilde katlanmalar gösterir. Plakalı yapılarda hidrojen köprüleri farklı polipeptid zincirleri arasında kurulur.

İki paralel polipeptid zinciri sekonder yapı oluşturduğunda zincirlerin birbirine yaklaştığı yerlerde kükürtlü aminoasitlerin aracılığıyla disülfit bağları oluşur. Kovalent yapıdaki bu bağlar son derece kararlıdır. Bu nedenle yapıya kararlılık kazandırır ve sekonder yapı denatürasyon koşullarında parçalanmaz.
Tersiyer Yapı ( Üçüncül yapı )
Protein molekülünün yuvarlak veya elipsoid bir şekil alabilmesi için ikinci yapıyı meydana getiren dizilişlerin üst üste katlanması veya yumak şeklinde sarılması gerekmektedir. Bu ise yan zincirlerin reaksiyona girmesi ile mümkün olur. Helezon yapısı veya düz tabaka yapısı dışında kalan zincirlere ait gruplar veya atomların meydan getirdikleri çeşitli bağlar ve güçler protein molekülünün içerisinde pek az boşluk bırakan sıkı ve belirli bir şekil almasını sağlar ( Şekil 2.6 ) ve tersiyer yapıyı oluşturur.
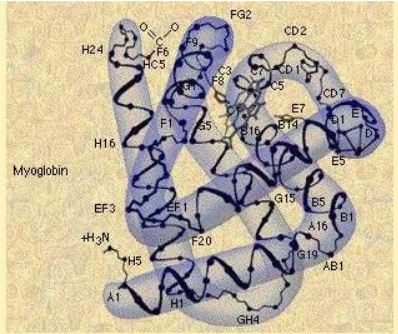
Tersiyer yapı genellikle globüler proteinlerde görülür ve bu proteinler tersiyer yapılarıyla üç boyutlu şekillerine kavuşurlar. Bu yapıda doğrusal yapının katlanması yolu ile katlı üçüncül yapıya ulaşılarak yüzeyler arası mesafe kısalmaktadır.
Kuarterner Yapı (Dördüncül Yapı)
Birden fazla polipeptid zinciri (alt birimi ) içeren proteinlerde polipeptid zincirleri tersiyer yapıyı oluşturan aynı bağ tipleriyle birbirleriyle salkımlar, topluluklar yaparak birleşir ve kuarterner yapıyı oluşturur. Hemoglobinin yapısında her biri myoglobine benzer dört protein monomeri (alt birimi) birbirine kuarterner yapıyı oluşturmak üzere çok sıkı bir şekilde bağlanmışlardır.


 Proteinler ve Beslenmedeki Önemi
Proteinler ve Beslenmedeki Önemi