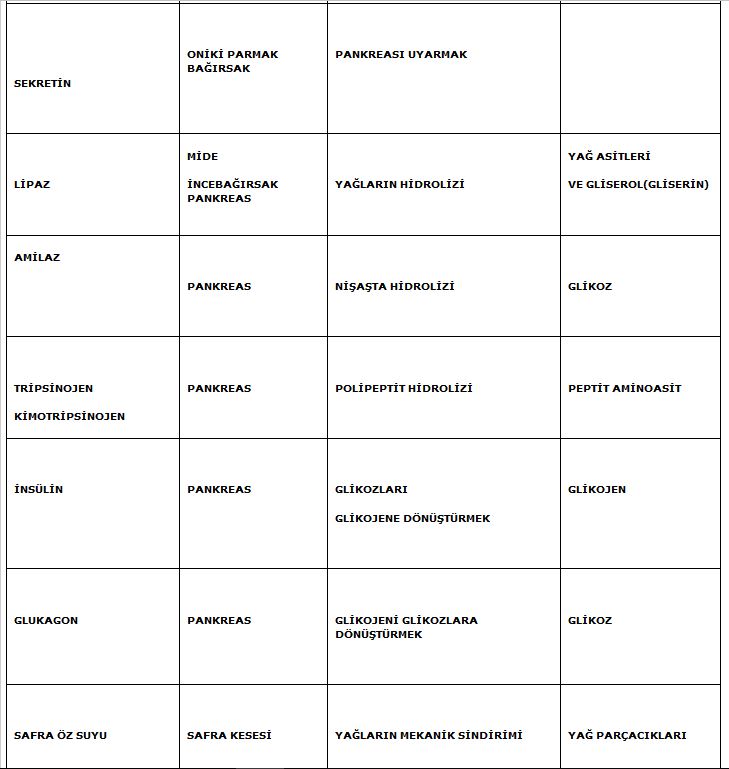
ENZİM AKTIVITESİ
Enzim Aktivitesini Etkileyen EtmenlerSponsorlu Bağlantılar
Bir enzimatik reaksiyonda, reaksiyon hızı bu faktörlerden değişik derecelerde etkilenmektedir. Ancak enzimatik reaksiyonlarda faktörler arası etkileşim de önemli olmaktadıı Örneğin bir enzimin en iyi aktivite gösterdiği pH değeri farklı ortam sıcaklıklarından etkilenerek değişiklik gösterebilir. Bu nedenle enzimatik reaksiyonlarda, ortam koşulları bir bütün halinde dikkate alınmalıdır. Enzim aktivitesini etkileyen önemli bazı faktörler aşağıda açıklanmıştır.
Enzim Konsantrasyonu
Enzim konsantrasyonunun enzim hızına etkisi, diğer koşullar sabit tutulduğunda, doğrusal bir ilişki gösterir. Yani enzim konsantrasyonu arttıkça enzim hızı da doğru orantılı olarak artar (Şekil 2.1). Ortamdaki her enzim molekülü bağımsız çalıştığı için ne kadar enzim molekülü varsa o kadar çabuk gelişen bir reaksiyon söz konusudur.
Substrat konsantrasyonu
Enzim miktarının sabit tutulduğu bir ortamda substrat yoğunluğu arttıkça, tepkimenin hızı da artar. Tepkime hızı en yüksek noktaya eriştikten sonra sabit kalır
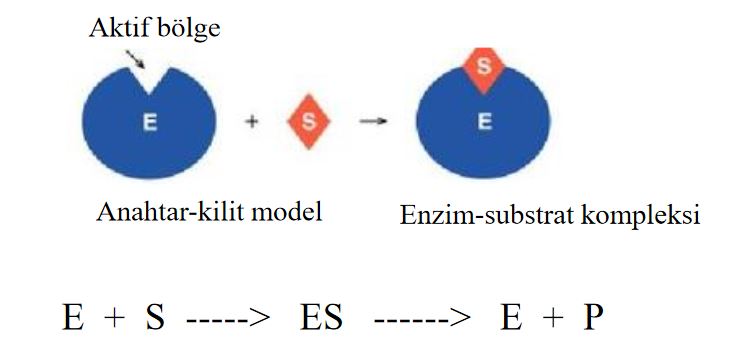
Enzim ile substrat, E+S -----► ES halinde iken enzim çalışmaktadır. Enzim görevini yapıp tekrar serbest iken ve birleşmek için substrat ararken çalışmamaktadır. Eğer ortamda bol substrat varsa enzim sürekli çalışm bir duruma gelir. Bu optimum substrat düzeyinin üzerindeki substrat değerleri, enzim reaksiyon hızına artı katkıda bulunmaz
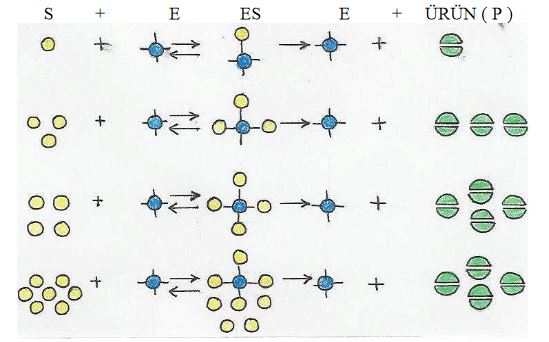
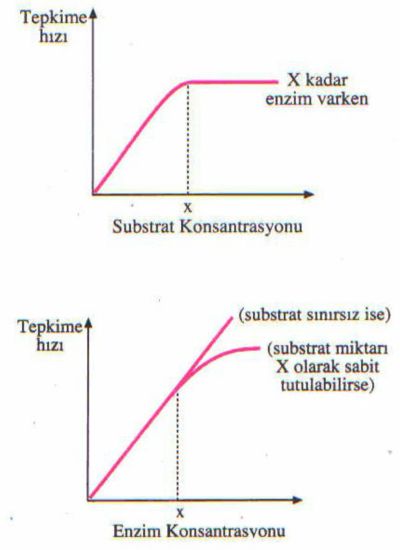
Enzim-substrat konsantrasyonunun etkisi
Sıcaklık
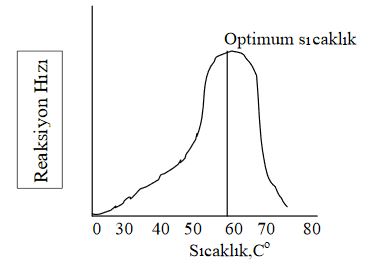
Sıcaklık, enzimlerin hem hızını hem de stabilitesini etkileyen önemli bir faktördür. Bütün diğer koşullar standardize edildiğinde, ortamının sıcaklığı arttıkça reaksiyon hızı da belli bir noktaya kadar artmaktadıı. Bu noktadan sonraki sıcaklı! artışlarında enzim hızında ani düşüşler meydana gelmektedir. Enzimlerin maksimum aktivite gösterdiği bu düşüş noktasına optimum sıcaklık adı verilir
Ortamın pH
pH derecesi ortamın asitlik ve bazlık derecesini ifade eder ve 0 - 14 arasında değişir. Ortam pHı enzimatik reaksiyonların çoğunda hızı etkileyen önemli bir faktördür. Her enzimin optimum çalıştığ !ir pH aralığı vardır ve bu pHa optimum pH denilmektedir.
Enzimlerin optimum pHları 2-10 arasında değişmektedir. Örneğin pepsinin optimum pHı 2 iken, alkalin fasfatazın 10dur. Şekil 2.6.da bazı enzimlerin optimum pHları verilmiştir. Bir enzimin çalıştığı optimum pH değeri mevcut değilse enzimin etkinliği azalı. Ayrıca kuvvetli asitler ve bazlar enzimlerin yapıs ını bozarak çalışmalarını engeller.

Su Aktivitisi
Bir gıdada suyun durumu, o gıdanın su ( nem ) içeriği ile onun çevresindeki havanın nisbi nemi arasındaki bir ilişki olarak ele alınır. Bu iki değer arasındaki oran ise su aktivitesi ( aw ) olarak tan ımlanır.
Enzimlerin büyük bir kısmı i şlevlerini su içerisinde gösterdiğinden, suyun miktarı da enzim işlevinde etken bir koşuldur. Genellikle % 15in altında su içeren ortamlarda, enzimler işlev göstermezler. Reçel ve pekmez yapımında bu faktör önemlidir. Sulandırılan reçel, bal ya da pekmez vb nin ekşimesi bu yüzdendir.
Kuru ortamda enzimler sıcaklığa daha fazla dayanı. Nem arttücça enzimlerin sıcakl^a karşı hassasiyetleri de artar.
Enzim inhibitörleri
Enzim-substrat kompleksinin oluşmasını değişik şekillerde etkileyen, enzim faaliyetinin azalmasına yol açan doğal veya yapay kimyasal maddelere enzim inhibitörleri, bu olaya ise enzim inhibisyonu denir. Bu maddeler istenmeyen enzim aktivitesinin önlenmesi veya kontrol altında tutulmasında aracı olarak kullanılm Enzim inhibitörleri: tersinir-geri dönüşümlü ( reversible ), tersinmez-geri dönüşümsüz (irreversible) ve allosterik inhibitörler olmak üzere 3 başlıkta incelenebilmektedir.
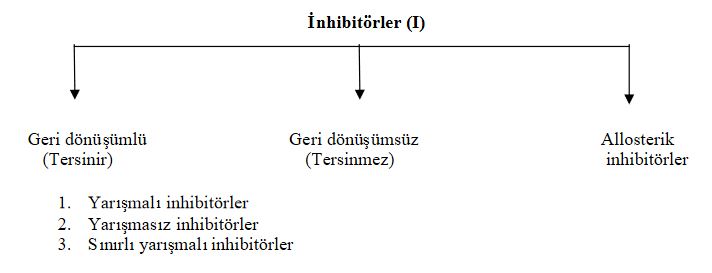
İnhibitörlerin gruplandırılması
Yarışmalı inhibitörün kimyasal yapısı ve şekli substratınkine çok benzemekte ve enzimin aktif merkezi ile geri dönüşümlü olarak birle şebilmektedir. Ancak oluşan enzim- inhibitör ( EI ) kompleksinden ürüne geçiş mümkün değildir. Ortamda yarışmalı inhibitör bulunduğunda, bu inhibitörle substrat arasında enzimle birleşme yönünde bir yarışma olur. Bu durumda ortamdaki enzim moleküllerinin bir kısmı substrat ile birleşmekte ve buradan ürün oluşumu gerçekleşmekte, bir kısım enzim ise inhibitör ile birleşmekte ve ürün elde edilememektedir.
Bu tip inhibisyonu azaltmak içinde ortamdaki substratın konsantrasyonunu arttırabiliriz. Ortamda substratın bol olması, enzimin substratla birleşme şansını artıracaktır.
Yarışmasız inhibitörler ise substrata hiç benzememekte veya çok az benzemektedir. Enzime aktif merkez d ışında diğer bir bölge üzerinden bağlanmaktadır. Bu nedenle, substrat ile inhibitör aras ında enzimle kompleks oluşturma yönünde bir yarışma söz konusu değildir. Bu durumda da, ortamdaki enzimlerin bir kısmı E,S ve EI kompleksleri halinde ise bir kısım enzim E,I,S kompleksi oluşturmaktadm E,I,S kompleksinden ürüne geçilememektedir. Ancak enzimin geri dönüşümlü olarak bu kompleksten ayrılarak tekrar serbest hale geçme ve substrat ile ES kompleksi yaparak ürün oluşturma şansı vardır. Bu anlatılanlar aşağıdaki şekilde şema tize edilebilir.
Sınırlı yarışmalı inhibitörler ise ES kompleksine bağlanarak inhibisyona neden olur. İnhibitörün direkt olarak enzime bağlanıp EI kompleksi yapması söz konusu değildir. Şu şekilde şematize edebiliriz.
Geri dönüşümsüz inhibitörler enzime kovalent bağlarla (elektronların ortaklaşa kullanılması) geri dönüşümsüz olarak bağlanı. EI kompleksinden tekrar serbest enzime dönüş veya ürün oluşumu söz konusu değildir. Bu nedenle ürün oluşumu ancak ortamda serbest enzimle birleşebilen substrat üzerinden olabilir. Geri dönüşümsüz inhibitörlere enzim zehirleri adı da verilmektedir. İnhibitörün enzime bağlanması aktif merkez ya da başka bir bölgeden olabilmektedir. Ağır metal iyonlar (Hg+2,Ag+2 gibi), oksidan maddeler (hidrojen peroksit vb.), hidroksil amin geri dönüşümsüz inhibitörlere örnek verilebilir.
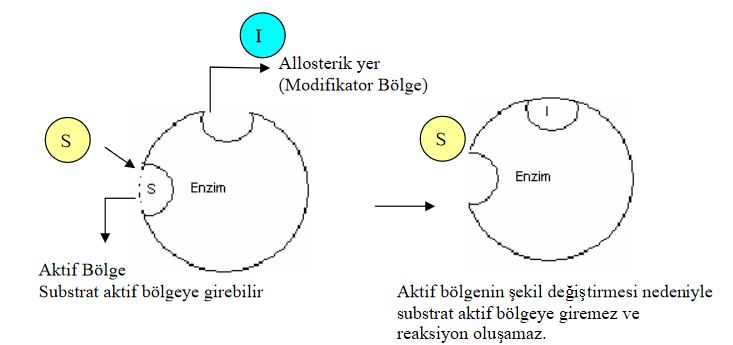
Allosterik inhibitörler ise yapısında aktif merkez dışında modifikatör adı verilen bir başka bölge daha bulundurur. Allosterik inhibitörler enzimlerin modifikatör bölgesine bağlanır. Bu bağlanma sonucunda, enzimin aktif merkezinde substratın bağlanmasına olanak vermeyen şekilsel bir değişim meydana gelir ve buna bağlı olarakta ES kompleksi oluşamaz.
Aktivatörler
Bazı enzimler aktivitelerini artırmak için aktivatör adı verilen iyonlar veya küçük moleküllere gereksinim duymaktad ı. Aktivatörler genellikle metal iyonların Aktivatörlerin bir kısmı yalnızca substratla, diğer bir kısmı ise enzimle birleş erek aktivatör rolü oynar.
Enzimle birleşen aktivatörler küçük metal iyonlandrn K+, Mg+2, Zn+2, Fe+2, Ca+2 ve Co+2, Cl-, Br-, F" , I" ve OH" vb. aktivatördür. Örneğin; Cl" a amilaz m aktivitesini 2 kat artırmaktadrn. Yalnızca enzimin substratı ile birleşerek görev yapan aktivatörlere di ve
trifosfatların Mg+2 ve Mn+2 ile yaptıkları kompleksler örnek gösterilebilir.
Örneğin; MgATP (Magnezyum Adenozin Tri Fosfat) gibi.
Basınç
Normal gıda işlemleri enzimleri tek başına inaktive edecek derecede bir basınç yaratmamaktadır. Ancak yüksek sıcakl ıklar ile uygulanan basınç enzim inaktivasyonuna neden olmaktadır.
Gıda dokuların in dağılmasma olanak vermeyen hidrostatik basınçlar gıdadaki enzimleri tam olarak inaktive etmemektedir. Gıdaların basınçla muamelesinin birkaç alt birimden ( polipeptitden ) oluşmuş enzimler üzerinde daha etkili olacağı ve bas inç yeterli düzeyde ise bu alt birimlerin dağılarak enzim aktivitesinin kaybolabileceği bildirilmektedir.
Gıda Sanayisinde Enzim Kullanımı
Gıda sanayisinde kullan ilan enzimler başlıca 3 kaynaktan elde edilir: Bitkiler, hayvanlar ve mikroorganizmalar.
Gıda sanayisinde en sık karşılaştığımız enzimler şunlardır:
Karbonhidrazlar
Bu enzimler karbonhidratların hidrolizini katalize etmektedirler. Gıda endüstrisinde yaygın olarak kullanılan karbonhidrazlar aşağıda verilmiştir.
Amilazlar
Amilazlar; a- amilaz ve P- amilaz olarak iki srnifa aynlıı Bunlar nişastanın hidrolizini katalize eder, başlıca maltoz ve dekstrin ile az miktarda glikoz oluşur. Amilazlar doğada bulunur, elde edilmeleri için kaynak bakterilerdir. Amilazların en yaygın kullanıldığı gıda endüstrisi alanları ekmekçilik, tatlı şurup üretimi ve bira üretimidir.
Normal unda a-amilaz az miktarda bulunmaktadı. Bu nedenle una eklenen ekmek katkı maddelerinde ticari olan , a-amilaz ve / veya malta zorunlu olarak yer verilmektedir. a- ve P-amilazlar, mayanı hamurdan etil alkol fermantasyonunu gerçekleştirmek için gereksinim duyduğu fermente edilebilir şekerlerin oluşmasını sağlar. Yine amilazlar, ekmekçilikte hamur kıvamını azaltı. Bunu önlemek için pişme sıcaklığım dayanıklı, a- amilaz kullanılmalıdır.
İnvertaz
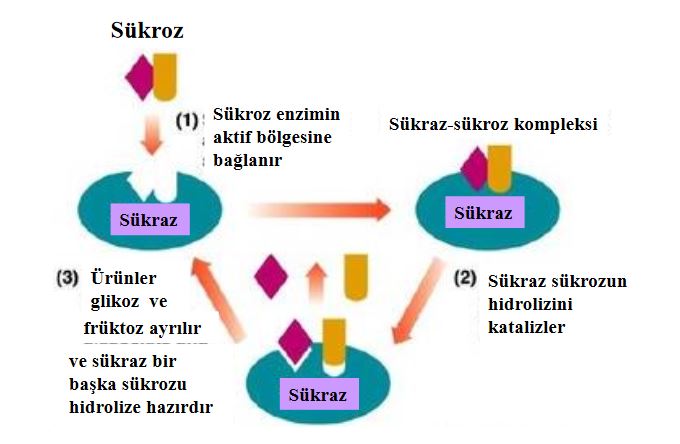
Karbonhidratlardan invertaz, sakkarozun hidrolizini sağlayan enzimdir ve sakkaroz, sükraz vb isimleri ile de bilinir. İnvertaz enzimi gıda endüstrisinde genelde invert şeker eldesi amacıyla kullanılır. İnvert şekerin iki önemli avantajı sukrazdan daha çözünür olması ve üründe kristalleşme sorunu yaratmamasıdır. Bu nedenle de invert şekerlerle ş ekerlemecilik ile likör, yapay bal ve dondurulmuş tatlı ve benzeri üretimlerde yaygın olarak kullanılmaktadır.
Laktaz ( B.galaktosida)
Bu enzim bir disakkarit olan laktozu monosakkaritleri olan galaktoz ve glikoza hidroliz etmektedir. Laktaz enzimine en yaygın olarak dondurmacılıkta, kumlu veya taneli ürün elde edilmesine neden olan laktoz kristalleşmesinin engellenmesi için başvurulmaktadı. Ayrıca peynir suyunun hayvan yemi olarak değerlendirilmesiyle, ekmekçilikte ve laktoz oranı düşürülmüş veya laktoz içermeyen süt mamüllerin elde edilmesinde kullanılmaktadır.
Pektik enzimler (pektinazlar )
Pektik bitkilerin hücre duvarında ve hücre içinde bulunan bir kompleks karbonhidrattır. Pektin ve benzeri pektik maddeler meyve ve sebze sularının eldesinde ürüne geçmekte ve ürüne bulanıklık kazandırmaktadır.
Pektik enzimler, pektini hidrolizi ederek bulanıklık yapma özelliğinin kaybolmasına neden olur. Pektik enzimlerden bazıları şunlardır: pektin metil esteraz ( PME, pektaz ), polimetilgalakturanazlar ( PMG ), poligalakturanazlar ( PG ), pektik asit liyazlar ( PAL ), pektik asit liyaz enzimi, domates gibi bazı işlem görmemişgıdalarda yapısal bozulmalara neden olmaktadı.
Izomerazlar
Glikoz izomeraz glikozun fruktoza dönüşmesini katalizleyen bir izomerazdır. Glikoz şurupları bu enzimden yararlanılarak tatlılık derecesi daha yüksek olan fruktoz şuruplarına dönüştürülebilmektedir. Glikoz şurupları özellikle nişastadan elde edilmektedir
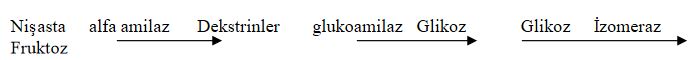
Nişastadan fruktoz şurubu eldesinde kullanılan enzimler
Proteolitik enzimler ( proteazlar, proteinazlar )
Bu enzimler proteinlerdeki peptit bağını hidrolize eder. Gıdaların yapısı, gıdada mevcut olan veya sonradan eklenen proteazların, proteinleri hidrolize etmesi sonucu değişmektedir. Örneğin, bir protein olan jelatin bileşimine bromelin içeren ananas eklendiğinde jelleşme özelliğini yitirmektedir. Rennin ve rennet sütü koagüle ederek jelleştirmektedir.
Proteazlann gıdanın yapısını değiştirme özelliğinden ekmekçilik ve et endüstrisinde de yararlanılmaktadı. Proteazlar buğday unundaki glüteni (un proteini) hidrolize etmekte ve böylece de hamur vizkozitedeki düşüşle birlikte vizkoelastik bir özellik kazanmaktadı. Böylece hamurun yoğrulma özelliği iyileşmekte, ekmek kalitesi artmaktadır.
Et endüstrisinde papain, fisin ve bromelin gibi bitkisel proteazlar ile fungal proteazlardan et yumuşatma amacıyla yararlanılmaktadır. Bu proteolik enzimler etteki elastin ve kollajeni ( et poteinleri) kismi hidrolizasyona uğratarak etin yumuşamasına neden olur. Yine proteazlardan biracılıkta biyolojik olmayan bulanıklığ ( biradaki protein ve tanninin gözle görülebilir partiküller halinde kompleks oluşturulması) engellemek için de yararlan ılmaktadıı. Bu tip uygulamalar ile biralar soğuğa karşı dirençli hale gelirler.
Proteotik enzimler, gıda endüstrisinde jelatin, pepton ve aspartam ( tatland ırıcı) eldesi amac ıyla da kullanılmaktadır.
Lipazlar
Lipazlar yağları hidrolize eden enzimlerdir. Lipazlara bazı peynir çeşitlerinde ve tereyağlannda özel tat-koku geliştirmek amacıyla başvurulmaktadıı.
Oksidoredüktazlar
Glikoz oksidaz
Bu enzim küflerden elde edilmektedir. Glikoz oksidazın gıda endüstrisindeki kullanımı ise; enzimin bazı gıdalardan çok az miktarda bulunan glikoz ve / veya oksijeninin uzaklaştırılması prensibine dayanmaktadır. Yumurta tozunun elde edilmesinde, kurutma öncesinde glikoz oksidaz kullan iminin temel nedeni yumurtadaki eser ( az ) miktardaki glikozun uzaklaştırılmasıdır. Böylece muhafaza sırasındaki enzimatik olmayan esmerleşme engellenmiş olur . Meyve suları, bira, şarap veya mayonez gibi gıdalarda ise glikoz oksidaz eser miktardaki oksijenin ortamdan uzaklaştırılmasını sağlar. Böylecede enzimatik esmerleşmeler ve /veya oksidatif acılaşmalar engellenmiş olur.
Lipoksigenaz
Lipoksigenazın gıdalar üzerinde istenen veya istenmeyen yönde değişiklik yaratan bazı etkileri vardı. Lipoksigenaz buğday ve soya fasulyesi ununda karotenoidleri etkileyerek ağarmaya neden olur. Bu durum beyaz ekmek üretiminde istenmesine karşılık makarna üretiminde istenmez. Yine lipoksigenaz, gıdalarda klorofil ve karotenleri parçalayarak istenmeyen renk de ğişimlerine neden olabilmektedir. Bunun dışında gıdalarda oksidatif tat ve aroma bozulmalarına ( samanımsı bir tat ve aroma ),vitaminler ve proteinlerde oksidatif parçalanmalara ve elzem yağ asitlerinin (lineoleik, linolenik ve araşidonik asitler) oksidasyonuna da yol açabilmektedir.
Gıda endüstrisinden yararlanılan önemli bazı enzimleri tanımaya çalıştık. Şimdi ise enzimlerin gıda endüstrisindeki kullanım amaçlarından bahsedelim.
Enzimler gıda endüstrisinde genel olarak değişik bir ürün elde etmek ve / veya ürüne istenilen özellikler kazandırmak amacıyla kullanılmaktadır.

Ekmekçilikte kullanılan enzimler

Süt ve süt ürünleri endüstrisinde kullanılan enzimler

Biracılıkta kullanılan enzimler
Enzimlerden gıda endüstrisinde diğer bazı özel amaçlarla da yararlanılabilmektedir. Ömeğin gıda endüstrisinde kullanılan bazı özel katkı maddeleri enzimlerden yararlanılarak üretilebilmektedir.
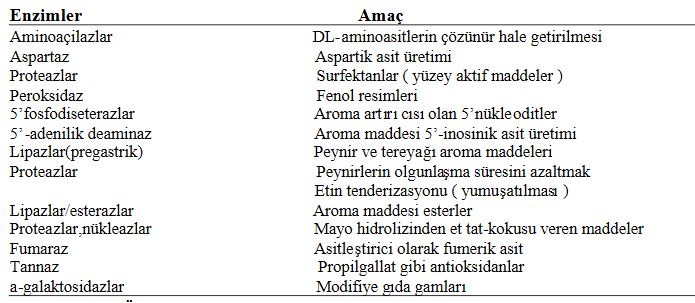
Özel katkı maddeleri veya istenilen bir etkinin enzimatik yolla elde edilmesi
Bu konuda diger bir örnek ise işlem görmemi ş ( ham ) maddelerdeki toksik ( zehirli ) veya beslenme değerini düşürücü öğelerin enzimatik yolla uzaklaştırılmasıdır

Gıda ham maddelerindeki istenmeyen bile Şklerin enzimatik yolla uzaklaştınlması
Son düzenleyen Safi; 4 Mayıs 2016 03:27
SİLENTİUM EST AURUM

 Enzim Nedir? Enzimler Hakkında
Enzim Nedir? Enzimler Hakkında