İYON
a. (ing. ion; yun. ion'dan). Elekt. ve Fizs. kim. Bir ya da birçok elektron kazanmış ya da yitirmiş bir atom ya da bir atom grubundan oluşan, elektrik yüklü parçacık.
Elektrotekn. İyon giderme, bir anahtarın iki elektrotu arasında oluşan ve doğal görünümünden sonra almaşık akım biçiminde bir arkın yeniden sıçramasına yol açan iyonları yok etme.
Fizs. kim. iyon bağı, iyon kristallerinde ters işaretli iyonları elektrostatik çekimle birleştiren bağ. (Eşanl. AVRIKKUTUPLU BAĞ.)
İyon kristali, salt pozitif ya da negatif iyonlardan oluşan kristal. (Bu iyonlar alkali ve toprak-alkali metaller gibi son derece elektropozitif ya da halojenler, kükürt ve oksijen gibi son derece elektronegatif elementlerden meydana gelir (Örneğin sodyum klorür, sezyum klorür.] Ayrıca karbonat
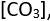
nitrat
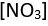
ve amonyumda
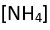
olduğu gibi atom gruplarından oluşan iyonlar da bilinmektedir; bu tür bir kristalde temel etkileşim kuvvetleri elektrostatik kökenlidir; bu iyonların kristal yapıları basittir; elektriği ve ısıyı çok iyi yalıtırlar.)
Nörobiyol. iyon akımı, sinir ve kas hücrelerinde, zarın iki tarafında eriyik halinde bulunan iyon türlerinin taşıdığı akım. (Bk. ansikl. böl.)
Nük. müh. iyon motoru, nükleer enerjiyi elektrik enerjisine dönüştürme ilkesine dayanarak çalışan motor.
Opt. iyon çözümleyicisi, iyon mikroskobu, gözlenen cismin yaydığı iyonlarla görüntü oluşturan çözümleyici, mikroskop.
Tip. iyon tedavisi, İyonlaştırıcı ışınlarla yapılan tedavi. (Bk. ansikl. böl.)
Uz. havc. iyon itmesi, itici maddeyi iyonlaştırıp bir elektrik alanıyla hızlandırdıktan sonra elektrik bakımından yansız halde püskürtmeye dayanan itme biçimi.
Yerbil. iyon değişimi, katı cisimlerde, iki iyonun yalnızca belirli sınırlar içinde gerçekleşebilen karşılıklı yer değiştirmesi. (İyon değişimli iz elementler yerbilimsel termometre olarak kullanılır.)
ANSİKL. Elekt. ve Fizs. kim. Çözeltilerdeki iyonlar. Çözeltilerin özelliklerini ve elektroliz olaylarını açıklamak için Arrhenius, sulu çözeltide asitlerin, bazların ya da tuzların aynı anda iyonlar halinde ayrıştığı varsayımını ortaya attı. Bu iyonların bir kısmı pozitiftir ve bir asit sözkonusu olduğunda bir elektron yitirmiş hidrojen atomundan oluşur, dolayısıyla mutlak değeri bir elektronun e yüküne eşit bir yük taşır; bir baz ya da tuz halinde ise mutlak değeri ne'ye eşit bir yükü olan bir metal atomudur ve n, metalin değerliğidir. Negatif iyonlar ise molekülün geri kalan bölümünden kaynaklanır.
Kristalleşen bir tuzda, iyonlar kristal kafesinin düğümlerinde yer alır; örneğin bir deniz tuzu kristali Na+ iyonları (bir elektron yitirmiş sodyum atomları) ve Cl- iyonları (bir elektronu kazanmış klor atomları) içerir. Çözeltide iyonlar ayrılır ve elektrostatik etkiyle birleşme eğilimi gösterir; ama suyun, çekimi azaltan görece büyük elektrik geçirgenliği (e, = 80) ve sürekli darbeler yüzünden statik bir denge kurulur: iyonlaşma tersinir ve kısmidir (en azından zayıf elektrolitler için). Bu denge iyonsa! ayrışma katsayısı'nın değeriyle belirtilir; a ile gösterilen bu katsayı (0< a <1) ayrışmış molekül sayısının, ayrışma öncesi toplam molekül sayısına oranına eşittir. Bu oran elektrolite ve koşullara (sıcaklık, derişim) bağlıdır. Kütle etkisi yasasının, statik dengeye uygulanması, genellikle elektrolitin derişimi O'a yaklaştığında, anın artarak 1e yaklaştığını gösterir.
Kısmi ayrışma varsayımı günümüzde ancak belli sakınımlarla kabul edilir: ayrışma katsayısı kavramı, "zayıf denen ve seyrettik çözeltide bile az ayrışan belli bir elektrolit sınıfı için geçerlidir; bunun tersine, "güçlü denen çok sayıda elektrolitin, az seyrettik çözeltide bile, hemen hemen tamamen ayrıştığı benimsenir. Elektrolit özelliklerini nicel olarak yorumlama, önemli problemlere yol açar.
Bir çözelti içindeki iki elektrota farklı potansiyeller verilirse, iyonları devindiren bir E elektrik alanı oluşur: pozitif iyonlar katota (bu yüzden katyon denir) doğru ve negatif iyonlar anpta (bu nedenle anyon adını alır) yönelir, iyonların türlerine göre farklılık gösteren yer değiştirme hızları E elektrik alanıyla orantılıdır: v = KE. K orantılılık değişmezi, iyonun devingenliğini gösterir; bu devingenlik çok düşük ve saatte santimetre düzeyindedir: örneğin, en yüksek hızla devinen H + iyonu için V/cm başına K = 0,003 29 cm/sndir.
iyonlar elektrotlara ulaştıklarında yüklerini yitirir ve birleşerek ya da elektrotlara ve elektrolite etkiyerek yeni moleküller verir. Bu olgu, elektroliz ürünlerinin yalnız elektrotlar üzerinde toplanmasının nedenini açıklar.
iyon kavramı kimyada temel kavramdır, çünkü çözelti halindeki elektrolitlerin gösterdiği iyon tepkimeleri konusunda birçok olayı yorumlamaya olanak verir; bu olaylara şu örnekler verilebilir: çözeltilerin, içerdikleri iyonların türlerine göre değişen renkleri; güçlü bazlar ve asitler için, H + ile OH- iyonlarından yalnızca bir mol suyun oluşumu sonucu açığa çıkan, dolayısıyla bütün baz ve asitler için aynı olan yansızlaşma ısısı; çok zayıf da olsa suyun iyonlara ayrışmasına yol açan, tuzların hidroliz tepkimeleri; yine yalnızca iyonların ayırtedicı özelliğini veren çökelme tepkimeleri. Bütün bu tepkimeler için, açık iyonsaI yazım, olayların doğrudan anlatımını sağlar Böylece iyonlar kuramı kimyaya değerli bir katkı ve çok verimli bir düşünce biçimi kazandırır.
Gazlardaki iyonlar.
İyonlar gazlarda çeşitli nedenlerden doğabilir: - çok yeğin elektrik alanı: örneğin iletken bir ucun yakınında, gazın iyonlaşmasından ve oluşan iyonların ışınımsal olarak yeniden birleşmesinden kaynaklanan bir yayıntı gözlemlenir;
- gazdan geçen yüksek enerjili parçacıklarla çarpışma: hızlandırılmış elektronlar, radyoaktif cisimlerin yayımladığı a, 0, y ışınları. Bu parçacıkların oluşumuna yol açtığı iyonlardan, yine bu parçacıkları algılamak için yararlanılabilir (sayaçlar ve algılayıcılar);
- X ve morötesi ışıması: bu olgu fotoiyonlaşmadır;
- ısıl çalkalanma: gazdaki parçacıkların ortalama enerjisi iyonlaşma enerjisinden büyükse, parçacıklar arasındaki şoklar iyonların doğmasına yol açar.
Gazlar ancak kısmi olarak iyonlaştırılabilir. Tümüyle iyonlaştıklarında, bunlara plazma adı verilir: yıldız atmosferlerinde, iyonosferde, Güneş rüzgârında bu olgu sözkonusudur.
Katilardaki iyonlar,
iyonlar katı hal yapısında, özellikle iyon kristallerinde büyük bir rol oynar.
Nörobiyol.
iki tip iyon akımı vardır: dinlenme akımları, hücre içi ve dışı arasındaki iyon bileşimi farklarından doğar, enerji tüketen pompaların metabolizma etkinlikleriyle dengelenir; eylem akımları, iyonoforların açılmasına bağlıdır ve eylem potansiyeli de denen sinir akımını doğurur.
Tıp. Doğal ya da yapay radyoaktif maddeler ve X ışınları, genellikle tüm maddeleri olduğu gibi canlı dokuları da etkileyerek yolları üstünde karşılaştıkları atomlardan bir elektron ya da bir nötronun salıverilmesine ve böylece dokuların içinde iyonlaşmaya neden olurlar. Böylece ortaya çıkan iyonlar, ikincil bir iyonlaşma da yaratabilirler; buna ikincil ışınlanma denir. Işın tedavisinin temeli bu olaydır; bu nedenle radyoaktif maddelerin ışınlarına ve X ışınlarına İyonlaştırıcı radyasyon denir.
İYONLAŞMA
a. Fiz. ve Kim.
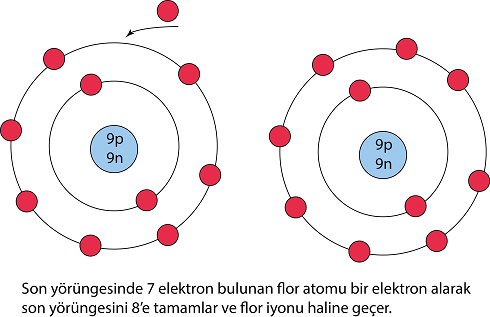
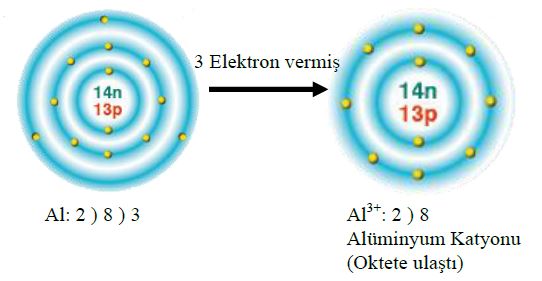
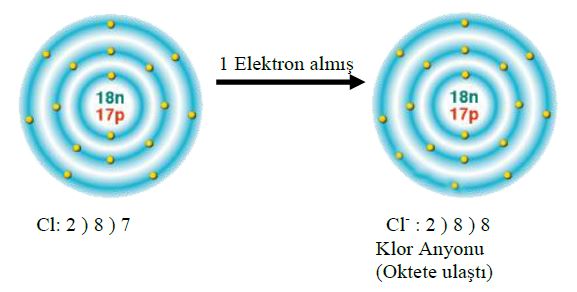
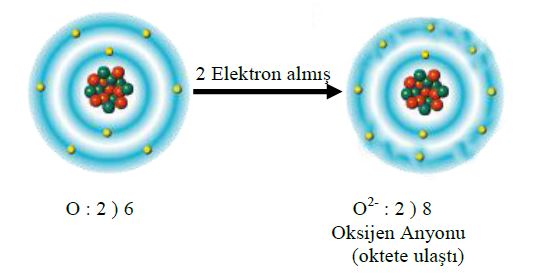
1. Yansız bir atom ya da bir molekülün artı ya da eksi elektrik yükü taşıyıcısı haline geldiği süreç. (Bir atom, bir ya da birçok elektron kazanarak eksi bir iyon haline gelebilir. Öte yandan, elektronlarından bir ya da birçoğunu yitirerek artı iyona da dönüşebilir.)
2.
- iyonlaşma enerjisi, bir atom, bir iyon ya da bir molekülden kinetik enerji vermeden.bir elektron koparmak için gereken enerji. (Genellikle elektronvolt cinsinden ölçülür.) [Bk. ansikI. böl.]
- İyonlaşma potansiyeli, elektronvolt cinsinden ifade edilen iyonlaşma enerjisiyle aynı değerde eV çarpımı (e, elektron yükü) veren V potansiyeli.
Gezbil.
- İyonlaşma katmanı, iyonosferde yükseltiye göre iyonlaşmanın maksimum değere ulaştığı bölge.
- Atmosfer iyonlaşması, fotonlarla ileri ölçüde iyonlaşan ve kimi elektromanyetik dalgaların yayılmasında değişiklik doğuran atmosfer durumu.
Ölçbil. iyonlaşma odası, İyonlaştırıcı ışımaları ölçen aygıt. (Aygıtta bir gaz içinde oluşan iyonlar bir elektrik alanıyla yönlendirilir; bu da ölçmede yararlanılan elektrik akımının geçişine neden olur.)
ANSİKL. Fiz. ve Kim. Bir atom için, bir elektronun ayrılmasından kaynaklanan birinci iyonlaşma enerjisi, yüklü bir iyondan ikinci elektronu koparmak için gereken ikinci iyonlaşma enerjisi vb. ayırt edilir.
Elektronla çekirdek arasındaki bağ kuvvetlendikçe iyonlaşma enerjisi yükselir ve çoğu kez, atoma en zayıf bağla bağlı dış elektronlardan kaynaklanır. Dolayısıyla bu enerji, göz önüne alınan elementin kimyasal etkinliği açısından iyi bir göstergedir; birinci iyonlaşma enerjisi soy gazlarda yüksektir (helyum için 25 eV) ve bu durum kararlılıklarının nedenini gösterir; alkali metallerde ise düşüktür (sodyum için 5.4 eV) ve bu da güçlü tepkinlik göstermelerini açıklar.
Kaynak: Büyük Larousse

 İyon Nedir? İyon Çeşitleri (Katyon ve Anyon)
İyon Nedir? İyon Çeşitleri (Katyon ve Anyon)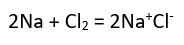
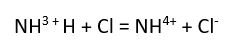
 şeklinde hidrate olur.
şeklinde hidrate olur.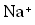 olarak yazılır.
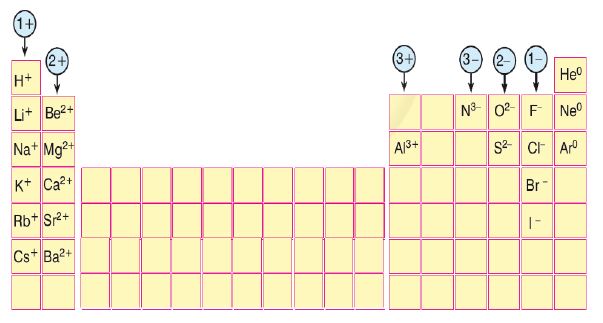
olarak yazılır. 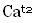 olarak yazılan bir kalsiyum iyonu, iki elektron kaybetmiş olan bir kalsiyum atomudur. Eksi yüklü klor iyonu Cl bir elektron kazanmış bir klor atomudur.
olarak yazılan bir kalsiyum iyonu, iki elektron kaybetmiş olan bir kalsiyum atomudur. Eksi yüklü klor iyonu Cl bir elektron kazanmış bir klor atomudur.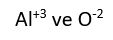 iyonlarından oluşan bileşiğin formülü yazılırken üstteki sayılar çapraz bir şekilde diğerinin altına getirilir.
iyonlarından oluşan bileşiğin formülü yazılırken üstteki sayılar çapraz bir şekilde diğerinin altına getirilir. 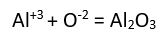 şeklinde yazılır.
şeklinde yazılır.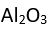 (Alüminyum oksit)
(Alüminyum oksit) yazılışında atomların ad ve sayıları belirtilmiştir.
yazılışında atomların ad ve sayıları belirtilmiştir. 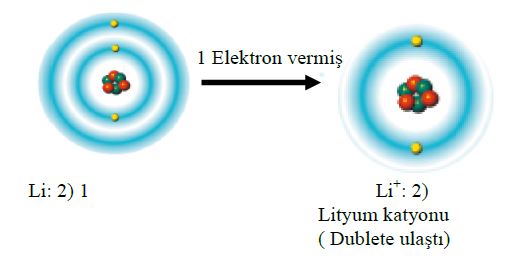
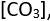 nitrat
nitrat 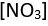 ve amonyumda
ve amonyumda 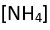 olduğu gibi atom gruplarından oluşan iyonlar da bilinmektedir; bu tür bir kristalde temel etkileşim kuvvetleri elektrostatik kökenlidir; bu iyonların kristal yapıları basittir; elektriği ve ısıyı çok iyi yalıtırlar.)
olduğu gibi atom gruplarından oluşan iyonlar da bilinmektedir; bu tür bir kristalde temel etkileşim kuvvetleri elektrostatik kökenlidir; bu iyonların kristal yapıları basittir; elektriği ve ısıyı çok iyi yalıtırlar.)