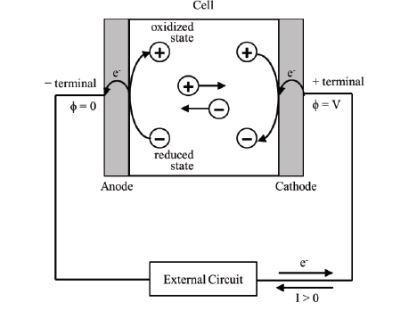
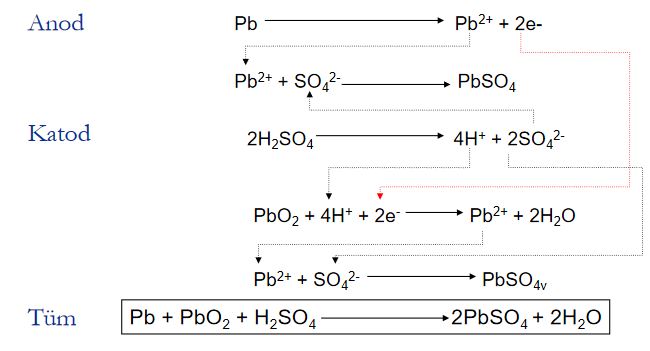
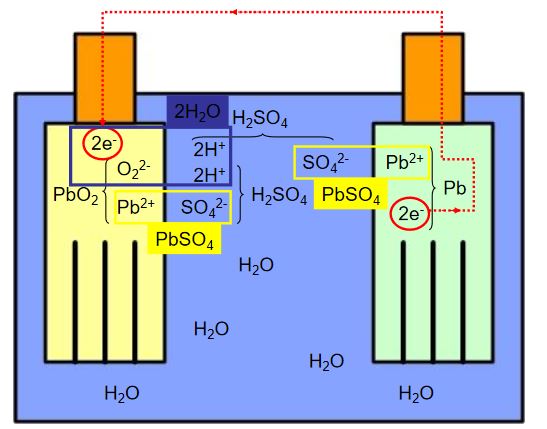
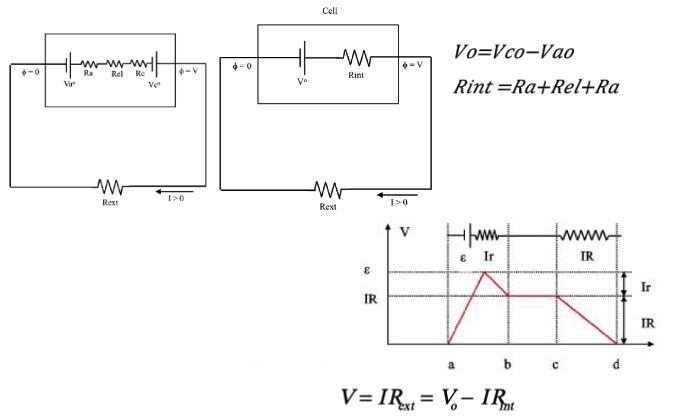
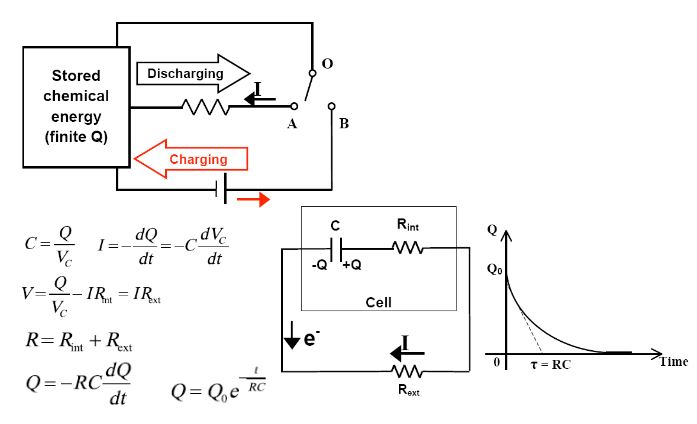
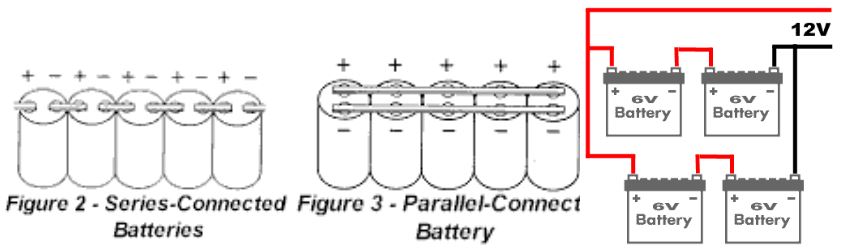
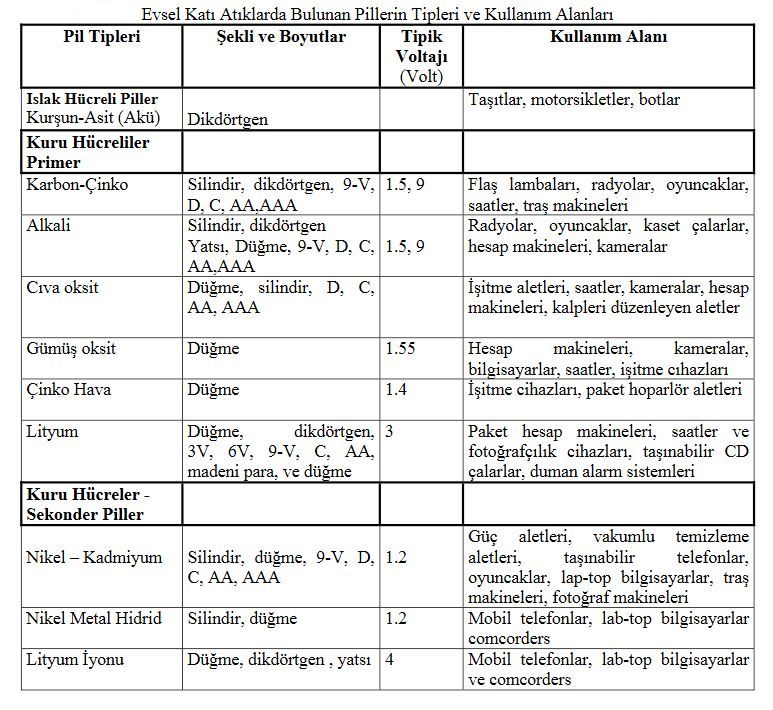
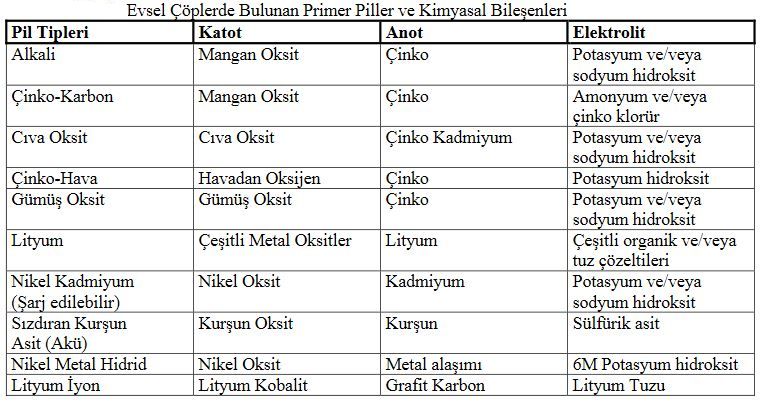
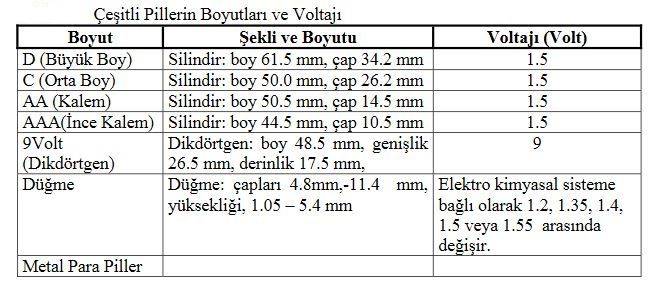
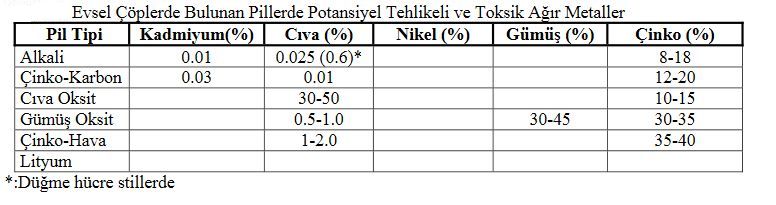
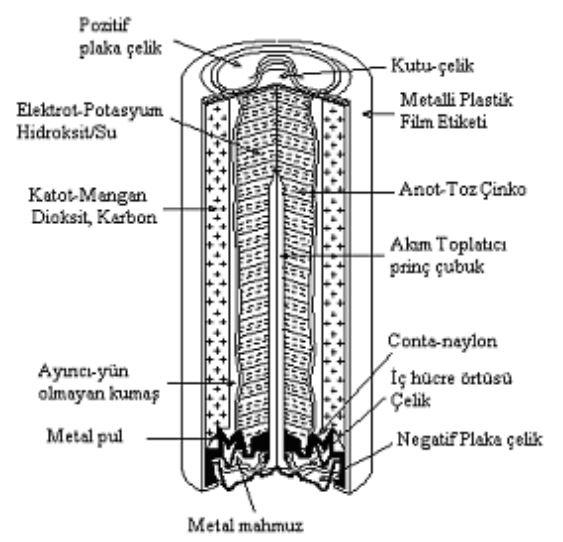
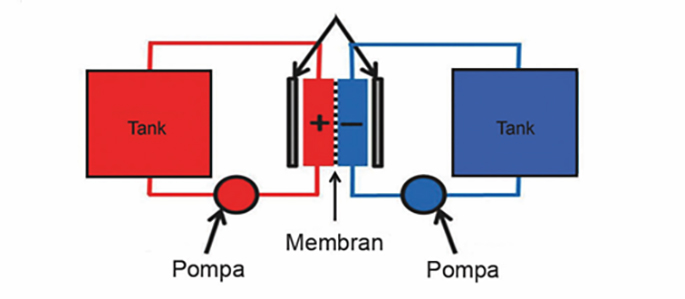
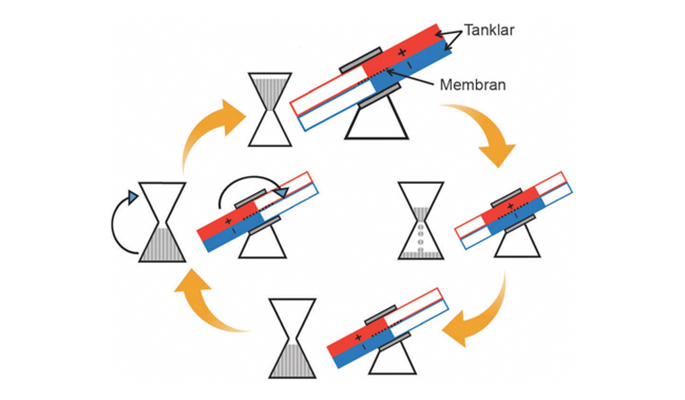
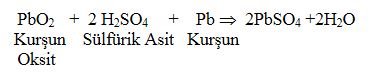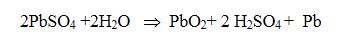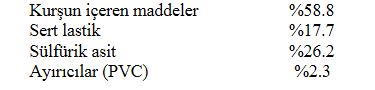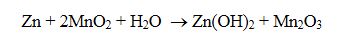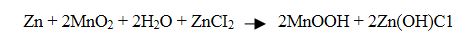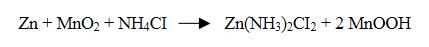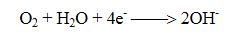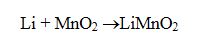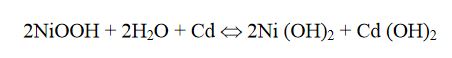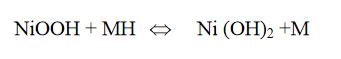Çinko Hava Pilleri
Katot olarak atmosferik havadan temiz edilen oksijen gazı (O2) kullanılır. Çinko anotta okside olurken katotta gerçekleşen reaksiyonu,
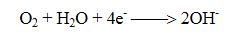
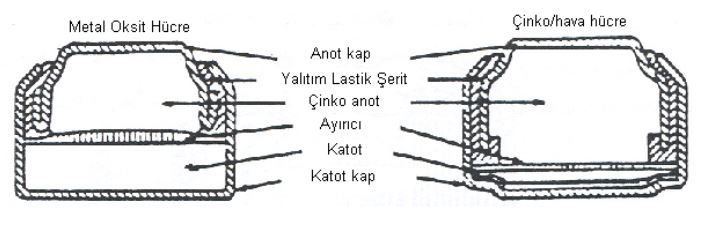
Elektrolit, %20 - 40 oranında potasyum hidroksit çözeltisi içerir. Potasyum hidroksiti elektrolit çözeltisi olarak kullanmakta büyük problem var. Havanın oksijeni kullanılırken havada bulunan karbondioksit potasyum hidroksitle reaksiyona girerek potasyum karbonat oluşur. Dolayısıyla bu reaksiyonlar pillerin kullanım ömrünü kısaltır. Bu sebepten dolayı bu tür piller genelde işitme cihazlarında kullanılır.
Çinko hava piller sürekli kullanımlar için değil, kesikli kullanımlar için uygundur.
Hem çok az nemli hem de çok fazla nemli ortamlar çinko hava pillerin ömrünü kısaltır. Havadan alınan oksijen, gözenekli, hidrofobik elektrot (karbon polimer veya metal polimer bileşeni) arasından elektrolizde çözünür.
Katot çevresinden taşınma söz konusu olmadığından dolayı bu pillerin enerji yoğunluğu oldukça yüksektir. Bu nedenle de işitme cihazlarında kullanılır.
Çinko - hava pillerde gazın serbest hale geçmesini önlemek için cıva oranı maksimum %5 cıva kullanılır. Çinko-hava piller sürekli kullanım için uygun değildir. Kesikli enerji tüketimi gerektiren aletlerde kullanılabilir. Çinko hava piller kendi kendine yılda %4 oranında deşarj olur.
Gümüş Oksit Piller
Gümüş oksit piller çok az miktarda kullanılır. Bu piller düğme şeklinde çeşitli boyutlarda üretilir. Alkali veya çinko-karbon düğme hücreli pillerden daha fazla sabit voltaj üretirler. Gümüş oksit piller, cıva oksit pillerle içten şarj edilebilirler. İşitme cihazlarında ve saatlerde kullanılmaktadır.
Cıva Oksit pillere göre gümüş oksit piller genelde çok daha pahalıdır. Gümüş oksit piller %1 oranında cıva içerir. Bu piller ayrıca gümüş de içerir.
Gümüş oksit pillerde gaz oluşumunu önlemek için cıva kullanılır. Gümüş oksit piller, diğer düğme pillere çok benzediğinden diğerlerinden ayırmak oldukça zordur.
Bu pillerde cıva miktarı %0.025 fazla olmamalıdır.
Gümüş oksit piller tehlikeli atıklar sınıfına girmektedir.
Cıva Oksit Piller
Bu pillerin üretimi bazı ülkelerde durdurulmuştur. Genelde düğme hücre tipi pillerdir.
Cıva Oksit Piller;
- Çinko/cıva oksit,
- Kadmiyum/cıva oksit,
olmak üzere iki gruba ayrılır.
Pil hücresindeki reaksiyonları; - Çinko-cıva oksit piller için: Zn+HgO > ZnO +Hg
- Kadmiyum/cıva oksit piller için: Cd + HgO + H2O > Cd (OH)2 + Hg şeklinde yazmak mümkündür.
Cıva oksit piller yerine, teknoloji geliştikçe daha az cıva içeren gümüş oksit ve çinko-hava düğme piller kullanılmaktadır.
Bu pillerin kullanımı sürekli azalmaktadırlar. Düğme hücreler halinde üretilmektedir. Ağırlığının 3/2si (%20-40) cıva oksittir. Kullanılmış cıva oksit piller tehlikeli atıklar sınıfına girer. Bir düğme hücre cıva oksit pili 800.000 litre içme suyunu kirletir. Yani 800.000 litre içme suyunu cıva kirleticisi bakımından standartların üzerine çıkartır.
Çöp depolama alanlarındaki cıva kaynağının %88ni piller oluşturmaktadır.
Lityum Piller
Lityum, metaller içinde en düşük redox potansiyeline sahiptir. Çok hafiftir ve toksik madde değildir. Bu sebeplerden dolayı lityum çok geniş alanda kullanımı araştırılmakta ve anot olarak kullanılmaktadır. Lityum hücreler çok uzun ömre sahiptir. Düşük hızda enerji tüketimi gerektiren aletlerde (saatler ve hesap makineleri gibi) küçük silindir veya düğme hücreler halindeki lityum piller kullanılır. Bu aletleri birkaç yıl çalıştırabilir.
Lityum piller hava ile temas ettiği zaman bozulur. Lityum çok aktif bir metaldir. Lityum su ile reaksiyona girdiğinde hidrojen gazı (H2) gazı açığa çıkar ve derhal pil hücresi patlar. Su ile reaksiyona girdiğinde hidrojen gazı (H2) gazı üretir. Buda hücrelere zarar verir. Susuz elektrolit kullanılır. Lityum pilleri tam olarak deşarj olmadan toplamak tehlikelidir. Bunlar çözünmüş lityum tuzu içeren polar organik sıvılar (dimetil eter veya propilen karbonat)dan ibarettir.
Poli etilen oksit/tuz kompleksleri gibi polimer esaslı elektrolitlerin kullanımı araştırılmaktadır.
Lityum piller, silindir, düğme veya metal para şeklinde üretilir. Askeri ve tıbbi aletlerde kullanılır.
Lityum pillerde ihmal edilebilecek miktarda cıva bulunur.
Lityum pil hücresinde reaksiyon;
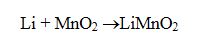
Lityum tonil pilleri tehlikeli atıklar sınıfına girerken diğer türleri (lityum-mangan dioksit, lityum-kükürt dioksit) tehlikeli atık değildir.
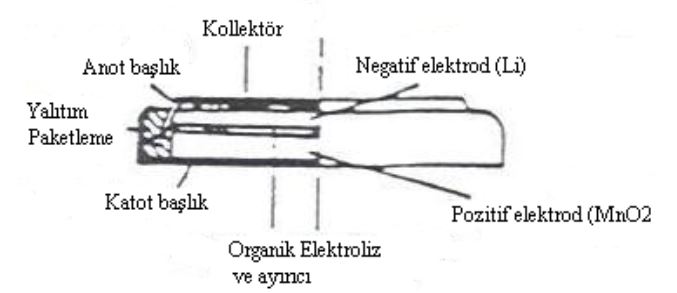
Lityum mangan dioksit pil kesiti.
ŞARJ EDİLEBİLİR PİLLER (SEKONDER PİLLER)
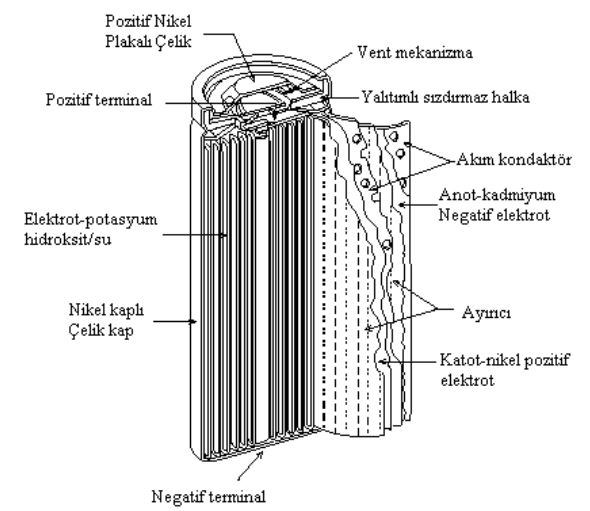
Nikel Kadmiyum Piller
Nikel Kadmiyum pilleri piyasada Ni-Cd veya Ni-Cads sembolleri adında satılmaktadır.
Bu pillerdeki reaksiyonu;
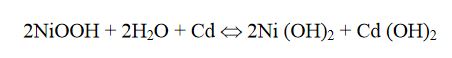
Ni (OH)2, CdI2 kaplı yapıya sahiptir. NiOOH, kompleks ve çok fazlı bir maddedir. Bu önemli bir avantajdadır. 1000 defa şarj imkanı sağlar ve kendi kendine deşarj olmaksızın uzun zaman kalmasını sağlar. Aşırı şarj, kadmiyum hidroksitin elektrotu pasifleştirilmesine neden olur.
Bu pillerde kadmiyum miktarı %11 ila 20 arasında değişir. Kullanılmış Nikel-kadmiyum piller tehlikeli atıklar sınıfına girer. Geri dönüşüm merkezlerinde eskisi getirilmeyen nikel-kadmiyum pillerin yenisi verilmemesi geri dönüşüm metotlarından biridir.
Dünyada son 30 yılda Ni-Cd pili üretiminde 16.000-18.000 ton kadmiyum tüketilmiştir. Dünyada üretilen kadmiyumun 2/3ü Ni-Cd üretiminde kullanılmıştır. Ni-Cd pillerin % küçük boyutludur. Evler aletlerinde, güç aletlerinde ve aydınlatma kullanılmaktadır. Geriye kalan V ise büyük endüstriyel hücre tipi bataryalardır.
Çöp depolama alanlarındaki kadmiyumun %50 si Ni-Cd pillerden ileri gelmektedir.
Nikel kadmiyum pillerin yerine mümkünse kadmiyum içermeyen nikel metal hidrid ve lityum pilleri gibi alternatifleri kullanılmalıdır.
Nikel Metal Hidrid (Ni-MH veya NiMH)
Nikel metal hidrit hücrelerde (Ni-MH veya NiMH), azot metal hidrit elektrottur ve protonlar oluşturmak için okside olabilen indirgenmiş hidrojenin katı kaynağı gibi hizmet eder.
Toplam reaksiyonu;
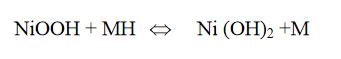
Anotlar, hidrojen depolama kapasitesine sahip metal alaşımıdır. Anot olarak bir metal alaşımı kullanılır. Kullanılan metaller,
V, Ti, Zr, Cr, Co ve Fedir. Ticari olarak en çok kullanılan metal alaşımı Li Ni5dir. Bu alaşımın her bir atomu 6 adet Hidrojen atomunu LaNi5H6 depolayabilirler.
Ticari Ni-MH pillerinin elektroliti, 6M KOH çözeltisidir.
Ni-MH pilleri kendi kendine boşalma hızları yüksek olan pillerdir. Ayda %20-25 oranında kendi kendine boşalır.
Ni-Cad pillerinin aksine Ni-MH pilleri toksik metaller içermez. Özel olarak bertaraf edilmesine gerek yoktur.
Ni-MH pilleri Ni-Cad pillere göre daha büyük kapasiteye (D boyut hariç) sahiptir. Ni-MH piller ayrı boyuttaki Ni-Cadden %40 daha yüksek ömre sahiptir.
Lityum İyon Pilleri (Li-Ion)
Lityum iyon (Li-Ion) pillerde, Lityum metali kullanılmaz. Çünkü Lityum metali çok aktiftir. Lityum metali yerine Lityum bileşiği kullanılır.
Lityum iyon pillerin katodunda lityum kobalit, LiCoO2, anotta ise grafik karbon ve elektrolizde lityum tuzu kullanılır. Lityum tuzu, susuz bir solventte çözülerek elektrolit elde edilir.
Lityum iyon pilleri Ni-Cad (Ni-Cd) veya Ni-MH (NiMH) pillerden oldukça hafiftir. Li-Ion pilleri, aynı boyuttaki Ni-MH pillerin dört katı güce sahiptir.
Lityum pilleri, düşük enerji tüketimi gerektiren aletlerde (duman alarmı gibi) kullanılması çok faydalıdır. Böylece uzun zaman (birkaç yıl) kullanılabilir.
Lityum piller özel olarak bertaraf edilmesi için yeterli miktarda zararlı ve zehirli madde içermez.
TOKSIK METALLERİN ETKİLERİ
Cıva
Piller çöpe atıldığı zaman katı atık depolama sahasında zamanla bozularak bazı tehlikeli ve zararlı maddeler serbest hale geçer. Bunlardan biride cıvadır.
Cıva doğada bozulmaz. Cıva ve cıva bileşikleri halk ve çevre sağlığı bakımından çok tehlikeli ve toksittir.
Akan pildeki cıva hızla deri veya solunum yolu ile vücuda girebilir. Bu maddenin eser miktarda suda bulunması dahi ciddi tehlike oluşturur. İçme suyu veya gıda zinciri yolu ile insan vücuduna giren cıva;
- Parastezi, ataksi, dişartri ve sağırlık gibi nörolojik bozukluklara,
- Merkezi sinir sisteminin tahribine ve kansere,
- Böbrek, karaciğer, beyin dokularının tahribine,
- Kromozonları tahrip edip sakat doğumlara, neden olmaktadır.
Cıva oksit pilindeki cıva miktarı 800.000 litre suyun kirleterek içme suyu standartları üzerine çıkartır.
Tüm pillerdeki cıva miktarı eser miktarda olsa dahi miktarı pil üzerine yazılmalı. Dünya Sağlık Teşkilatına göre içme suyunda cıvanın 0.001 mg/lt fazla olması istenmez.
Kadmiyum
Ağır metaller içerisindeki en tehlikeli ve toksit maddelerden biri kadmiyumdur. Piller çöpe atıldığı zaman depo sahasında piller bozularak Kadmiyum ve bileşikleri serbest hale geçerek suya karışır. Kadmiyumlu sızıntı suyu, içme suyunu ve toprağı kirleterek gıda zinciri ve içme suyu yolu ile insan vücuduna girer.
Kadmiyum;
- İtai - itai ve akciğer hastalıklarına, prostat kanserine, kansızlığa, doku tahribine,
- Anfiyen ve kronik neval tübüler bozukluğa ve böbrek üstü bezlerin tahribine neden olur.
Kadmiyumun vücuttaki yarılanma ömrü 10-25 yıl arasında değişir. Dolayısıyla havada, gıdada ve içme suyunda kadmiyum bulundukça, kadmiyumun sudaki birikmesi artarak devam eder.
İçme suyu veya gıda zinciri ile kadmiyumun %2si vücutta birikirken, solunum yolu ile gelen kadmiyumun %10-50si vücutta tutulur.
Vücut kadmiyumu kalsiyum gibi algılar ve kadmiyum vücutta birikmeye başlar. Vücutta kalsiyum eksilmesinden dolayı kemikler yavaş yavaş zayıflamaya başlar. Ayakta durmak hatta öksürmek bile kemiklerin kırılmasına hatta iskelet ufalanarak neticede hastanın ölmesine neden olur.
Ayrıca günde bir paket sigara içen insanların vücutlarında, daha ziyade karaciğer ve böbreklerinde sigara içmeyenlere nazaran %50 oranında daha fazla kadmiyum taşımaktadırlar.
Kadmiyum 400 0Cnin üzerinde aerosol halinde atmosfere geçer. Dünya Sağlık Teşkilatına göre içme suyunda kadmiyumun 0.005 mg/ltden fazla olması istenmez.
Evsel çöpteki kadmiyumun %50si pillerdeki kadmiyumdan ileri gelmektedir.
Tüm pillerdeki Kadmiyum miktarı eser miktarda olsa dahi miktarı pil üzerine yazılmalı.
Kurşun (Pb)
Kurşun vücuda solunum, içme suyu ve gıda zinciri yolu ile girer. Vücuda giren kurşun ciğerlere kadar ulaşır ve ciğerlerde yavaş yavaş absorbe edilerek kana karışır. Kurşun kan yolu ile önce karaciğer, böbrek, beyin ve kas gibi yumuşak dokularda 35-40 gün bekledikten sonra kurşun metabolitleri yardımı ile kemik ve diş gibi sert dokularda yarılanma süresi 20 yıldır.
Vücutta demir, kalsiyum eksik, D vitamini yüksekse kurşun fazla miktar birikir.
0-6 yaş grubu çocuklar kurşun kirliliğine karşı yetişkinlere göre en az 4 kat daha fazla etkilenirler.
Kurşun; işitme bozukluğuna, sinir iletim sisteminde ve hemoglobin bileşiminde düşmeye, kansızlığa, mide ağrısına, böbrek ve beyin iltihaplanmasına, kısırlığa, kansere ve ölüme neden olmaktadır.
Tüm pillerdeki kurşun miktarı eser miktarda olsa dahi miktarı pil üzerine yazılmalı.
Dünya Sağlık Teşkilatına göre içme suyunda kurşunun 0.05 mg/ltden fazla olması istenmez.
Pillerin Doğada Yok Olma Süreci
Cihazlar içerisinde bulunan pil ve bataryaların hizmet ömrü esnasında veya herhangi bir cihaza takılmadan muhafaza edilmeleri sırasında insan sağlığına hiçbir şekilde negatif etkisi bulunmamaktadır. Hizmet ömrünü tamamlamış veya herhangi bir şekilde hasar görerek kullanımı mümkün olmayan pillere ise atık piller denir. Atık pillerin çöpler vasıtasıyla toprağa karışması, denizlere, akarsulara ve kanalizasyonlara atılması veya yakılmaları durumunda içerdikleri kimyasal maddeler çevrenin kirlenmesine yol açabilmektedir. Ancak bahis konusu kirlenmenin tahmin edildiği gibi kısa sürede gerçekleşmesi mümkün değildir ve yapılan araştırmalarda bu sürecin 5-15 yıl kadar olduğu doğrulanmıştır. Diğer taraftan, tehlikeli atıklar bünyesinde bulunan atık piller oranının yalnızca %0,2 civarında olduğu Avrupa daki birçok katı atık depolama sahasında yapılan testler sonucunda belirlenmiştir.
Çinko-karbon ve alkali-mangan pillerinin bünyesindeki zehirli cıva maddesi tedricen azaltılmış ve bugün %0,0005 oranının çok altına indirilmiştir. Bu hesaba gör bir ton atık pil içerisinde azami 5 gram cıva bulunabilecektir ve bahis konusu miktarın çevre kirlenmesine ve insan sağlığına hemen hemen hiçbir negatif etkisi yoktur. Diğer taraftan, tanınmış pil markalarının büyük bir kısmı sıfır cıvalı olarak üretim yapabilmektedirler. Bu nedenlerle pillerdeki civa maddesi özellikle Avrupadaki geri kazanımcılar için artık bir sorun olmaktan çıkmış ve bu yönde yeni teknolojilerin geliştirilmesi hemen hemen durdurulmuştur. Buna karşılık düğme piller %2 ye kadar cıva içerebildiklerinden diğer pil atıklarından ayrıştırılması ve ilgili tesislerde geri kazanıma gönderilmesi gerekmektedir.Atık nikel-kadmiyum pilleri bünyesindeki nikel ve kadmiyum maddeleri çok uzun sürelerden beri geri kazanılmaktadır.Nikel değerli bir metaldir ve pillerden geri kazanılan kadmiyum maddesi de tekrar pil üretiminde kullanılır.Bu nedenle ve atık nikel-kadmiyum pilleri artı ekonomi yarattığından, bahis konusu atıklar %90 ve üzerinde bir oranla toplanıp, geri kazanıma yollanılabilmektedir. Dolayısıyla Ni-Cd pillerinden ötürü, kadmiyum maddesinin çevreye negatif etkiler yaratması fenomeni gittikçe etkisini kaybetmektedir. Ayrıca yukarıda da belirtildiği gibi, bu tür pillerin önümüzdeki 5 10 yıl içerisinde üretim ve pazarlanması çok büyük oranlarda kısıtlanacaktır.
PİL KULLANIMI VE BAKIMI
Lityum pilleri kullanıldığı zaman Lith-X veya D-Class küçük yangın söndürücü devamlı mevcut olmalıdır. Su bazlı yangın söndürücüler, lityum pillerde kullanılmamalıdır. Çünkü lityum su ile reaksiyona girerek fazla miktarda patlayıcı hidrojen (H2) gazı açığa çıkarır. Lityum pillerini ıslak elle tutulmamalıdır.
Lityum pillerini çöpe atılmamalıdır. Bu pillerdeki lityum su ile reaksiyona girerek patlamaya neden olabilir.
Sekonder (şarj edilebilir) piller kullanıldığı zaman pil için uygun şarj aleti kullanılmalıdır. Böylece şarj edilebilir pilin aşırı yüklemesi ve aşınması önlenir.
Ni-Cad pilleri, sıcakken kesinlikle şarj edilmemelidir. Özellikle yaz aylarında araç içinde kalan piller çabuk ısınır. Bu durumlarda piller soğutulmalı ve sonra şarj edilmelidir.
Sekonder piller, duman dedektörlerin de kullanılmamalıdır. Çünkü Sekonder piller kendi kendine yüksek oranda deşarj olurlar.
Tahrip olmuş, bozulmuş şarj edilebilir piller tekrar şarj edilmemelidir.
Pil hücresindeki bileşiklerle çıplak elle direk temas edilmemelidir. Pilin asidik veya bazik elektroliti, deri sulanmasına ve yanmasına neden olabilir. Cıva veya Kadmiyum gibi elektrot maddeleri çok toksittir. Diğer bileşikler vücutta çeşitli kısa süreli (sulanma ve yanmaya) veya uzun süreli (sinir sisteminin tahribatına) hastalıklara neden olabilir.
Piller ateşe atılmamalıdır. Pilin metalik bileşikleri yanmaz ve yanan elektroliz dağılabilir, patlayabilir veya toksik duman çıkarabilir. Piller endüstriyel tıbbi atık yakma tesislerinde yakılabilir.
Piller çantada açıkta taşınmamalıdır. Aksi durumda metal paraları, anahtarlar veya diğer metalik maddeler pille temas ederek kısa devre meydana getirebilir. Bu da aşırı ısınmaya, akıntıya veya patlamaya neden olur.
Pilleri muhafaza ederken kısa devre oluşturucu veya herhangi yük boşaltıcı yerlerden (metalik malzemeler gibi) uzak tutulmalıdır.
Pilleri soğuk ve karanlık yerlerde saklanmalıdır. Bu durum pilin ömrünü uzatır. Pilleri buzdolabında sızdırmaz bir kap içinde saklamak sağlıklıdır. Böylece pilin ömrü uzatılmış olur. Piller buzlukta kesinlikle depolanmamalıdır. Pili alete takmadan önce oda sıcaklığına gelmesi beklenmelidir.
Çok hücreli aletlerde farklı piller bir arada kullanılmamalıdır. Voltajlardaki, akımlardaki ve kapasitedeki küçük farklılık, tüm pillerin ortalama faydalı kullanım ömrünü kısaltır.
Sekonder pilleri çok hücreli alette kullanırken aynı yaşta ve aynı şekilde şarj edilmiş piller kullanılmalıdır. Böylece piller aynı hızda ve oranda deşarj olurlar.
Sekonder Ni-Cd pilleri zaman zaman hafıza kaybına uğrarlar. Bu durumlarda pilleri tam olarak deşarj ettikten sonra tekrar şarj edilebilir.
Piller yüksek sıcaklıkta kullanılmamalıdır. Isı kaynaklarından uzak tutulmalıdır. Aksi durumda elektriksel potansiyel, hızlı bir şekilde bozulacaktır.
Pil satın alırken kapasitesine (mAh) mutlaka bakılmalıdır. Kapasitesi düşük olan pillerin daha pahalıya mal olduğu unutulmamalıdır. Çinko karbon ve Ni-Cad pillerin kapasiteleri düşüktür. Ni-MH pillerin kapasiteleri orta ve Alkali ve Lityum pillerin kapasiteleri yüksektir.
Primer piller kesinlikle şarj aletine takılmamalıdır. Aksi durumda çok toksit ve tehlikeli olan maddelerin akmasına neden olunur.
KURŞUN -ASİT BATARYALARIN (AKÜ) TOPLANMASI
Dünyada toplam kurşun üretiminin takriben %47i kurşun ikincil eğitmeden elde edilmektedir. Kullanılmış akülerin %80-85i geri kazanılmakta ve geri kalan % 15-20 kısım çöp depolama alanındaki toplam kurşunun %65ni oluşturmaktadır.
1995 yılı verilerine göre dünyada yılda 96 milyon adet kurşun-asit bataryası üretilmektedir. Yıllık batarya büyüme hızı < %2 civarındadır. Özellikle gelişmekte olan ülkelerde taşıt sayısındaki artışlar paralel olarak akü tüketimi de artmaktadır.
A.B.D.de 1986 yılında akü üretiminde 941.000 ton kurşun kullanılırken bu değer 2000 yılında 1.200.000 tona çıkmıştır.
Almanyada 1998 yılında çıkan yasaya göre kurşun-asit akü üreticileri ürettiklerinden sorumludurlar. Dolayısıyla kullanılmış akülerine toplanmasından, geri dönüşünden ve bertarafından sorumludur. Kurşun- asit bataryalar (aküler) gelişi güzel olarak bertaraf edilmemelidir. Evsel çöplere kesinlikle atılmamalıdır. Bataryalar üzerinde aküler illegal olarak atı lam az, kullanılmış piller geri kazanılmalıdır, kanunlar kullanılmış bataryaların geri dönüşüm merkezlerine teslim edilmesi gerektiğini emrediyor gibi kullanıcıları uyarıcı bilgiler olmalıdır.
Otomotiv tamir bakım merkezlerinde ve oto garajlarında araçların bataryaları değiştirildiğinde eskisi bakım merkezinde kalmalıdır. Yani bu merkezler kullanılmış akü toplama merkezi olmalıdır. Vatandaş kurşun- asit bataryası satan yerlerden batarya satın alıyorsa eskisini teslim ettikten sonra yenisini satın almalıdır. Aksi durumda batarya verilmemelidir. Tamir bakım atölyeleri, akü satıcıları kullanılmış kurşun-asit bataryaları geri almak zorunda olmalıdırlar.
Kullanılmış akü geçici depolama yerlerinin kapasitesi 90 günden az olmamalıdır. Büyük kapasiteli yerlerde sert beton veya asfalt zemin ve duvar üzeri aside karşı dayanıklı epoksi boya ile kaplanmalıdır. Böylece asit sızıntısı veya akıntısı zemine veya duvara zarar vermemelidir. Sızdırma ve akıntı yapmayan akülerin en fazla beş adeti üst üste konabilir. Sızdıran bataryalar tek tek 18 litrelik sızdırmaz poli propilen kaplara konmalıdır. Küçük kapasiteli tamir-bakım ve satış merkezlerinde aside dayanıklı polietilen, poli propilen, veya PVC ile zemin duvarlar kapatılmalı ve üzerleri örtülmelidir. Depolama yerleri sızdırmaz olmalıdır. Akülerin depolandığına dair uluslar arası işaretler olmalıdır.
Kurşun-asit batarya toplayıcılar bu malzemeleri kesinlikle bertaraf edemezler. Akü toplayıcılar, Çevre ve Orman Bakanlığının izin verdiği ikincil kurşun ergiticilere bu malzemeleri teslim etmek zorundadırlar. Çevre ve Orman Bakanlığı akü toplayıcı ve geri kazanıcı firmaların oluşmasına ve gelişmesine öncülük etmelidirler. Sekondery kurşun ergitme tesislerinde kurşun, asit ve polipropilen geri kazanılır.
Kurşun-asit batarya toplayıcıları ve kurşun ergitme firmaları sık aralıklarla yerel yönetimler ve ilgili bakanlıklar tarafından denetlenmelidir.
Kurşun-asit bataryaların ve parçalarının çöpe atılması önlenmelidir. Maksimum geri kazanma ile ilgili yasal düzenleme yapılmalıdır.
KURU PİLLERİN GERİ KAZANILMASI
1986 yılında A.B.Dde kadmiyum tüketimi 4800 ton iken 2000 yılında bu değer 2285 tona çıkmıştır. 1986 yılında tüketilen kadmiyumun %28i pil üretiminde kullanılmıştır.
1988 yılında A.B.D.de 1755 ton cıvanın 225 tonu pil üretiminde kullanılmıştır. . Bu cıvanın da yaklaşık %73ü cıva oksit pillerinin üretiminde kullanılmıştır. Pillerde cıva azaltılması 1984 yılında başlamıştır. Beş yıl içinde pil içinde kullanılan cıva miktarı %86 oranında azaltılmıştır. Alkali pillerde cıva miktarı %97 oranında azaltılmıştır.
Almanyada yılda 30 000 ton, yaklaşık 900 milyon kuru pil tüketilmektedir. Pillerden temel pillerin %78i silindir alkali ve çinko karbon, %8.7 çinko cıva, gümüş oksit, alkali, çinko oksijen ve lityum, şarj edilebilir silindirik pillerin %7 nikel kadmiyum, %4 nikel hidrid, %1.2 isi nikel kadmiyum düğme ve nikel hidrid pildir. 14 milyon adet akü tüketilmektedir.
Her yıl İngilterede 20.000 ton pil depolama alanında bertaraf edilmektedir. Yine İngilterede bir konutta yılda 21 pil tüketilmektedir. İngilterede kuru pillerin geri kazanılması minimumdur. Bunların çoğu depolama alanına gitmektedir. Avrupa Topluluğu Ülkelerde 2001 yılında alınan kararla 2008 yılında kadmiyum pillerin kullanımı yasaklanacaktır. Almanyada pil üretimi için yılda 615 ton kadmiyum, 5.5 ton cıva, 5 ton gümüş, 600 ton nikel ve 4000 ton çinko kullanılmaktadır.
Dünyada pillerde kullanılan ağır metal miktarının azaltılmasında ana kriter,
1. Pillerde kullanılan ağır metal miktarını azaltmak,
2. Pillerin ayrı toplanarak bunların çevreye zararlarını minimize etmektir.
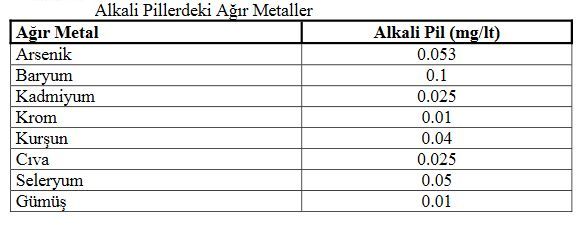
Almanya standardına göre pillerde cıva miktarı ağırlıkça %0.0005 den, hücre başına 25 mg dan (alkali piller hariç), alkali piller ağırlıkça %0.025 den fazla ise bu piller zararlı atıklar sınıfına girmektedir. Alkali pillerde kullanılan cıva miktarı pilin ağırlığına göre %0.025den fazla olmamalıdır. Kadmiyum miktarı ağırlıkça %0.025 den ve kurşun miktarı ağırlıkça %0.4 den fazla olan pillerde tehlikeli atıklar sınıfına girmektedir. Düğme-hücre pil üreticileri pil içindeki elektrot türünü açıkça belirtmek zorundadırlar (cıva oksit, çinko-oksit, gümüş oksit v.s.de kullanılan). Cıva konsantrasyonu 25 mg dan fazla olan düğme-hücre pillerin satışına izin verilmemelidir (bir ton alkali veya çinko karbon pil içinde 25 gram). Avrupa Topluluğu Ülkelerinde 1999 yılından itibaren 5 ppmden fazla cıva içeren pillerin kullanımı yasaklanmıştır. 2003 yılından itibaren tüm piller ayrı toplanmak zorundadır. 2004 yılında Avrupa Topluluğu Ülkelerinde tüketilen pillerin %75, sanayide tüketilen pillerin ise %95 toplanıp geri kazanılacaktır. Tüketilen pillerin %55den fazlası geri kazanılmak zorundadır. Yıllara göre pillerdeki cıva miktarındaki değişim. Tablo de görüldüğü gibi en fazla kullanılan alkali pillerde cıva miktarı önemli miktarda azaltılmıştır.

Pil üreticileri şarj edilebilir pilleri geri kazanıp bertaraf etmiyorlarsa satışına izin verilmemelidir.
Tüketiciler pillerin tipine, üreticiye ve pazarlamacıya bakmaksızın tüm pillerini geri toplamak ve geri dönüşüm kutusuna atmak zorundadır. Özellikler cıva oksit, gümüş oksit, nikel-kadmiyum veya sızdırmaz kurşun-asit bataryalar çöpe kesinlikle atılmamalıdır. Bu piller özellikle sağlık merkezlerinde, endüstride, ticarette ve resmi merkezlerde kullanılmaktadır.
Çöpe atılan pillerdeki ağır metaller zamanla bozunarak serbest hale geçer, sızıntı suyu ile birlikte yer altı sularının, toprağın ve yüzeysel suların kirlenmesine neden olur. Kirlenen yer altı sularını arıtmak çok pahalıdır. A.B.D.de katı atık depolama alanlarındaki cıvanın %88 ve kadmiyumun ise %54ü pillerden ileri gelmektedir. Almanyada evsel katı atık içindeki çinkonun %10, nikelin %67 ve kadmiyumun ise %85ü pillerden ileri gelmektedir.
Çöp yakma tesislerinde ise yanma sonucu bir grup ağır metal uçucu hale geçer, atmosferde geniş alana dağılır, akarsuların ve göllerin kirlenmesine neden olur. Baca gazı arıtma tesisinde tutulan tozlarda ağır metal konsantrasyonu yüksek olabilir. Bu tür atıklar dikkatli olarak incelendikten sonra depolanmalıdır. Küle karışan kısım ise çöp depolama alanında problem oluşturur.
Pilleri geri kazanma programı geliştirmeden önce ilk kademe olarak toplanacak pil tipleri belirlenmelidir. Toplanacak pil tipleri, halkla ilişkiler stratejisini, toplama yerleri merkezlerini, toplama kapları tiplerini ve nihai olarak bertaraf esasını etkiler. Genelde üç toplama stratejisi, 1. sadece düğme piller, 2. düğme piller
ve nikel kadmiyum piller, 3. tüm pillerin toplanması gibi geliştirilmiştir. Geri kazanma stratejisi
geliştirmede diğer önemli basamak, pillerin toplanması, taşınması ve bertarafı için yasal düzenlemelerin incelenmesi ve bilinmesi gereklidir. Yine pilleri toplamaya başlamadan önce pilleri toplamada kontrol yönteminin nasıl olacağının bilinmesi gereklidir.
Temel araştırmalar tamamlandıktan sonra pil toplama programında ilk basamak eğitim ve ödüllendirme için halkla ilişkiler programını geliştirmektir.
Aşağıda potansiyel promosyon stratejilerinin bir listesi verilmiştir.
1. Bir ana konu ve strateji belirlenmelidir.
2. Sık sık promosyonlar geliştirilmelidir.
3. Gazeteler, posterler ve torlar geliştirilmelidir.
4. Hakla duyuru anonsları, TV,radyo, yazılı basın, okul eğitim merkezleri, reklam panoları ve sivil toplum örgütlerinden yararlanılmalıdır.
Üçüncü basamak, pil toplama merkezleri oluşturulmalıdır. Bu merkezler halkı ödüllendirme programına uygun yerler olmalıdır. Bu bölgeler toplanacak pil tiplerinin yapısını yansıtmalıdır. Pil parakente satış merkezleri, ofisler, transfer istasyonları pil toplama merkezleri olarak kullanılabilir.
Pilleri toplayan kişileri tespit etme toplama merkezlerinin tipini belirlemenin bir fonksiyonudur. Toplama merkezi olarak parekante satış yerlerini kullananlar, genelde gönüllü kuruluşlar, komşuluk grubları, yaşlı vatandaşlardır.
Pillerin toplanmasında kullanılan çeşitli kaplar var. Evlerde kullanılan piller torbaları kırmızı renkli, üzerinde geri kazanma logosu ve e-mail adresi olmalıdır. Torbalar parakente satış merkezlerinden ve geri dönüşüm merkezlerinden ücretsiz temin edilebilmelidir. Bu yerlerde torbalar kolay görülebilir yerlere konmalıdır. Parakente satış merkezlerinde piller 7-8 litre büyüklüğünde farklı kovalarda toplanır. Kovalar üsten kapaklıdır. Kovalar sürekli kapalı, nemsiz yerde muhafaza edilmelidir. Bunlara bir örnek Şekil de verilmiştir. Şehrin muhtelif yerlerinde oluşturulan toplama bölgelerinde plastik torbalar kullanılabilir.
Toplama sıklığı zamanla ve tecrübe ile tespit edilir. Ayrıca toplanan malzemenin tipinin bir fonksiyonu olarak toplama sıklığı belirlenir. Perakende satış merkezlerinden piller belli aralıklarla pikaplarla toplanır. Eğer toplama merkezlerinde sadece düğme ve nikel-kadmiyum piller toplanıyorsa toplama sıklığı buna göre belirlenir. Tüm toplama merkezlerinin telefon ve e-mail adresleri olmalıdır. Şehrin muhtelif yerlerinde oluşturulan merkezlerden pikapla pil toplama programı ile pakakente satış merkezlerinden pil toplama programı birleştirilmelidir.
Yeterli sayıda pil ekonomik ve verimli bertarafı ile ilgili program belirlendikten sonra bu pillerin hangi tür kaplara konulacağı belirlenmelidir. Toplanmış piller korozyona dayanıklı polietilen 210 litre hacminde plastik varillerde depolanmalıdır. 210 litre varillerin ağırlığı 360 kgdır. Varillerin depolandığı yerler kapalı, nemsiz, mümkünse soğuk ve havalı ortamlar olmalıdır. Kötü hava şartlarından etkilenmemelidir. Aksi durumda bu piller bozunabilir. Yangına karşı güvenli ortam olmalıdır. Piller diğer tehlikeli ve yanıcı maddelerden ayrı yerlerde depolanmalıdır.
Yeterli miktarda pil toplandıktan sonra bu piller bertaraf edilebilir.
Yukarıda tarif edilen program sayılı sayıda pil üreticisi firma veya yerel yönetimlerle birlikte yapılmalıdır. Sayılı sayıda geri dönüşüm merkezlerinde piller sınıflara ayrılabilir. Ayrıştırılan piller bertaraf tesisine gönderilir.
Tüm pil üreticileri ürettikleri pillerin üzerine Çöpe Atılması Yasaktır ibaresini veya şeklini koymalıdırlar.
PİLLERLE İLGİLİ YAPMASI GEREKLİ ÇALIŞMALAR
Türkiyede tüketilen pil türleri belirlenmelidir. Özellikle cıvalı ve kadmiyumlu pillerin ülkeye girişinde sınırlamalar getirilmelidir. İthalatçı firmalar bu konuda önceden uyarılmalıdır. Kullanıcılar (özellikle hastaneler) bu konuda bilgilendirilmelidir. Gereğini yerine getirmeyenler cezalandırılmalıdır.
Akü üreticileri kesinlikle bayileri vasıtasıyla aküleri geri kazanmalı ve çevreye zarar vermeyecek hale dönüştürmelidirler. Bu konuda ilgili akü üreticileri ile toplantılar yapılıp gereği devreye girdirilmelidir.
Bunların ülkede kullanımım sınırlandırılmalıdır. İstanbulda pil tüketimi yılda 5 milyon ile 18 milyon adet arasında değişmektedir. A.B.D.de yılda tüketilen pil miktarı 3 milyardır. Bu pillerin %75i Alkali pillerdir, %15i çinko karbonlu pillerdir. Nikel-kadmiyumlu piller %1 oranındadır. İl belediyelerinden başlanarak pillerin ayrı toplanması sağlanmalıdır. Bu konuda belediyeler aşağıdaki çalışmaları yapabilirler.
- Pillerdeki cıva, kadmiyum ve kurşun gibi zehirli ağır metaller konusunda halkı bilinçlendirmek .
- Pillerin ayrı toplanmasını sağlamalı. Kırmızı renkli pil kutuları ile pil toplama merkezleri oluşturmak.
- Vatandaşların pilleri nasıl ayrı toplayacakları konusunda bilgilendirmek.
- Kırmızı renkli pil toplama araçları oluşturmak.
- Pil toplama işlemini İllerin geneline yaygınlaştırılmalı.
- Pillerin depolama alanlarında ayrı özel hücrelerde depolanması sağlanmak.
- Medyaya piller konusunda bilgi verilmek.
- Pillerin tehlikeli madde (cıva,kadmiyum ve kurşun gibi) içerdiğini gelişi güzel kullanılmaması gerektiğini anlatmak.
- Akmış pillerin çok tehlikeli olduğunu, eldivensiz dokunulmaması gerektiği ve ellerin mutlaka yıkanması gerektiği öğretilmek.
- Pillerin tehlikeli madde içermesi sebebiyle dille kontrol edilmemesi gerektiği kamuoyuna duyurulmak.
kaynak: Çevre ve Orman Bakanlığı
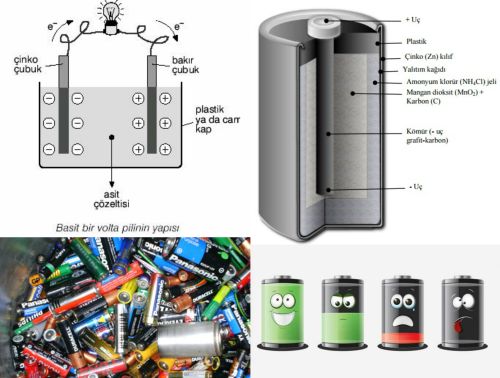

 Pil Nedir? Pilin Özellikleri ve Yapısı Hakkında
Pil Nedir? Pilin Özellikleri ve Yapısı Hakkında