Su Kimyası Korozyon Nedir?
01.Giriş
Korozyon geniş anlamlı bir sözcüktür. Sözlük anlamı, paslanma, aşınma, çürüme, bozukluk, çürüklük şeklindedir. Teknik açıdan ise, önceleri sadece metale özgü bir deyim olarak kullanılmış, sonraları en sert taşlarla, tahta vb. malzemelerinde korozyonundan bahsedilir olmuştur. Korozyon, nitelik olarak mekanik ve kimyasal olarak sınıflandırılabilir. Mekanik korozyonda sürtünmeden kaynaklanan aşınma, dolayısıyla madde kaybı söz konusudur, maddenin özelliğinde değişme olmaz sadece şekli bozulur. Kimyasal korozyonda ise, madde değişerek özelliğini yitirir, metalik kökenlidir.
Metalik korozyonda, metal, kimyasal ve elektro kimyasal reaksiyonlarla iyon haline geçerek metalik özelliğini yitirir. Bu tür korozyon metalin, doğada bulunduğu hale dönme eylemi olarak tanımlanır. Metaller, doğada saf halde bulunmazlar, genellikle oksit, sülfür ve karbonat cevherleri vardır. Bu cevherler, metallerin en kararlı durumlarıdır, ancak metal, saf haldeyken kendisini cevherden arındırmak için harcanan enerji kadar bir enerjiyi geri vererek hızla doğada bulunduğu cevher durumuna dönmeye meyleder.
Kimyasal korozyon, normal ve elektro kimyasal olarak iki kısımda yorumlanabilir.
Normal kimyasal korozyonda, herhangi bir elektrik akımı yoktur. Tekdüze reaksiyonlar sonucu kimyasal kinetiğin temel yasalarına uygun olarak, dış etkenler nedeniyle metal yapılarında oluşur. Yüksek sıcaklık ortamında kuru gazların neden olduğu korozyon buna örnektir. Ayrıca asit kullanan veya üreten endüstri kollarında da kimyasal korozyon çok görülür.
Elektrokimyasal korozyonda ise, mutlaka bir elektrolit ve elektrik akımı vardır. Nemli havada toprak ve su altı yapılarında oluşan korozyon buna örnektir.
Elektrokimyasal korozyon su ve elektrik gibi gömülü boru hatlarında büyük zararlar verir. Örneğin yeraltındaki metal su borularının sızıntılarına ve patlaklarına sebep olur. Sonuçta, işletmede durma, onarım zorunluluğu, iş gücü ve parasal kayıplara yol açar.
Elektrokimyasal korozyona genellikle galvanik korozyon da denir. Zira, korozyona sebep olan akım dıştan değil, pil oluşmasından hasıl olmaktadır. Pil, bilindiği gibi bir elektrolit içine daldırılmış anot ve katottan oluşur. Anot ve katot bir iletkenle birbirlerine bağlandığında akım geçer ve anotta korozyon oluşur. Eğer anot, bir yapının veya metal bir iletim hattının bir bölümünü oluşturuyorsa, sistemde büyük bir korozyon oluşur.
Elektrik enerji tesislerinin çoğunda bu durum görülür. Bu tesislerdeki metal bölümler anot, katot ve bağlantı iletkeni gibi davranabilir. Toprak içindeki su veya nem, pil devresini tamamlayan elektrolit olur. Böylece yapı, doğal bir korozyon pili gibi davranır.
Demir boruların suyla temas ettiği bir ortamda, demir + 2 değerlikli katyon şeklinde solüsyona geçer, arkasında 2 elektron bırakır, diğer katyonlarla yer değiştirir. Örneğin saf suda H+ iyonlarıyla yer değiştirir. H+ iyonları elektronlarla birleşerek H2 gazını meydana getirirler. Demir 2 katyonunun solüsyondan ayrılması korozyonu doğurur :
2 Fe++ + 1/2 O2 + H2O + 4 OH- à 2 Fe(OH)3
Korozyon hızı, genellikle hidrojenin çözülmüş oksijenle birleşmesi yani sudaki çözülmüş oksijen konsantrasyonu ile ilgilidir.
Demiri olmayan metallerde benzer şekilde korozyona neden olabilirse de çoğunun oluşturduğu oksit veya karbonatlar metali korozyondan korur. Örneğin alüminyumun kalın bir oksit tabakası, bakırın ve çinkonun karbonatları gibi.
Korozyon mekanizması oksideredüksiyon (redoks) ve çözeltilerin elektrolizi teorileriyle gayet açık olarak izah edilebilir.
02. Korozyon Teorileri
1. Okside - Redüksiyon Teorisi : Redoks diye de adlandırılan okside redüksiyon teorisi maddenin atom yapısına bağlı bir kuram üzerine kurulmuştur.
Maddenin özelliğini taşıyan en küçük parçası olan atom bir çekirdek ve elektronlardan oluşur. Çekirdek pozitif, elektronlar ise negatif elektrikle yüklüdür. Elektriksel bakımdan nötr olan atom bazı etkiler sonucu elektron verir veya alır. Böylece iyon haline dönüşür ve elektron vermişse pozitif, almışsa negatif olur. Birinci durumda oksidasyon yani yükseltgenme, ikinci halde redüksiyon yani indirgenme söz konusudur. Oksidasyon durumunda
Fe àFe++ + 2 e-
Metalik demir 2 elektron kaybederek pozitif iyon haline geçer. Bu iyon da karşılaştığı bir negatif iyonla birleşerek çözeltiye geçer. Böylece demir korozyona uğramış olur. Redüksiyon durumunda ise,
Fe++ + 2 e- à Fe
demir 2 elektron alarak metalik demir haline döner. Görüldüğü gibi metal korozyonuna engel olmak için elektron kaybının önlenmesi zorunludur.
2. Çözeltilerin Elektrolizi Teorisi : Asit, baz ve tuzların sulu çözeltileri içine daldırılan ve bir iletkenle bağlanan 2 metalden akım geçirildiğinde, çözeltiyi oluşturan madde pozitif ve negatif iyonlarına ayrılır.
Pozitif elektrik yüklü iyonlar akımın elektrolitten çıktığı katot, negatif yüklü iyonlar ise akımın elektrolite girdiği anot denilen metal tarafından tutulur.Katot tarafından çekilen (+) iyonlar yani katyonlar, kaynak tarafından yayılan (-) elektronlarla birleşerek nötr olurlar. Yan reaksiyonlar olmazsa katotta bir metal birikmesi veya hidrojen çıkışı olur. Katodun madde durumu değişmez.
Anot tarafından çekilen (-) iyonlar, yani anyonlar elektron kaybederek nötr olurlar. Kaybedilen elektronlar elektrik kaynağına dönerler. Böylece elektrolit anodun madde kaybına karşı yenileşir ve anot korozyona uğramış olur.
03. Korozyon Çeşitleri
Genellikle dört tip korozyonun varlığı kabul edilir :
1. Galvanik Korozyon : Hızlı paslanmalar, genellikle iki ayrı metalin arasındaki galvanik faaliyet sonucu (galvanik pil olayı) olarak ortaya çıkar. Bu faaliyet bildiğimiz bir flaş lambasının pilinde meydana gelen işlemin aynısıdır.
2. Elektrolitik Korozyon : Elektrolitik korozyon ve elektroliz korozyon, tesislerin yapısı sırasında insanların sebep olduğu paslanma olayıdır. Bu olayın başlıca kaynağı elektrikli tren ve tramvayların demir yollarındaki elektrik akımıdır. Bu işletmelerde genellikle bir doğru akım kaynağı mevcuttur. D.C. kaynağın bir ucu hava hatları vasıtasıyla elektrikli tren veya tramvaya verilir, dönüş iletkeni olarak da demir raylar kullanılır. Rayların tekbir parçadan yapılması mümkün olmadığından ek yapılması zorunluluğu ortaya çıkmıştır. Bu ekler de kötü yapılırsa, bu kötü ekin sonucu direnç arttığından akım ek yerinden devam etmeyip, o noktadaki toprak üzerinden devresini tamamlar. Bu toprak da kablo, boru vs. olabilir, devresini onun üzerinden yapar. Genellikle akımın borulara girdiği noktalarda değil, boruları terk ettiği noktalarda borulardan madeni parçalar taşıyarak korozyonu meydana getirdiği tespit edilmiştir.
3. Gerilme Korozyonu : Madenlerin iç gerilmeleri, o madenin imalat tekniğine, içindeki katkı maddelerine, su verilmesine ve maden haline geldikten sonra muhtelif tezgahlarda bazen darbe ile dövülerek, bazen taşlanarak vb. işlemlerle iç gerilmelerinde farklılıklar meydana gelir. Aynı cins maden olsalar da işlenmiş bir maden parçasıyla işlenmemiş arasında iç gerilme farklarının mevcudiyeti yukarıdaki sebeplerden dolayıdır. Aynı cins metalin biri işlenmiş, diğeri işlenmemiş olarak bir konstrüksiyonda kullanılırsa bunların birbirine temas ettiği noktalar arasında en azından hava kalacaktır veya bazı şartlarda bir elektrolit tabaka içinde kalırlar. Bu halde ise iki plaka arasında bir pil teşekkül eder, (madenin iç gerilme farkından) buda gerilme korozyonu'nu meydana getirir.
4. Biyokimyasal Korozyon : Biyokimyasal korozyon, bakteri faaliyetleri sebebiyle toprağın değişikliğine sebep olan kimyasal maddelerin meydana getirdiği olaydır. Şimdilik, toprak ve sudaki bu tip korozyonun ana sebebinin sülfat azaltıcı bakterilerin olduğu bilinmektedir.
04. Korozyona Sebep Olan Etkenler
1) Metallerin elektrot potansiyellerinin farklı olması nedeniyle, sistemde birbirinden farklı metal kısımların bulunması halinde potansiyeli daha negatif olan metal bölümü iletkenlik sağlandığında anot, diğeri katot olur. Örneğin bakır - çelik, bakır - font bölümleri olan bir metal yapıda pil oluşarak korozyona yol ayar.
2) Aynı cins bir metalin bileşiminin tekdüze olmaması için, yani metal yapısındaki saf olmayan bölümler, alaşım bileşiminde yer yer farklılıklar, metaller içinde çeşitli artık maddelerin bulunuşu, fabrikasyon kusurları, metal yüzeyindeki koruyucu kaplama veya oksit tabakasının her yerde aynı olmayışı pil oluşumuna sebep olarak korozyon hasıl ederler.
3) Metalin hazırlanması esnasında yapılan işlemlerde farklılıklar, tavlama, temizleme, parlatma, cilalama gibi.
4) Zeminin değişen kimyasal yapısı, oksijen veya nem miktarındaki değişmeler, litolojik yapı farklılığı, mikrobiyolojik organizmaların işlevleri gibi nedenlerle korozyon kutupları oluşur.
5) Elektrolit (zemin suyu veya yer altı suyu) içindeki farklı konsantrasyondaki çözünmüş tuzlar, gazlar, elektrolitin akış hızında farklılıklar, sıcaklık değişimleri, erimiş oksijen miktarı, suyun pH değeri, alkalinitesi, karbondioksit içeriği gibi çeşitli etkenler korozyona sebep olabilir.
05. Korozyondan Korunma Yolları
Yapının bulunduğu çevredeki doğa şartlarını değiştirmek genellikle mümkün olmadığı için, korozyonu önleme veya geciktirme yolları araştırılır. Bu konuda birinci adım çevre şartlarına dayanıklı metalin seçimidir. İkinci yöntem metalin bir koruyucu ile kaplanması yani çevreye karşı izolasyonu, üçüncü yöntem ise katodik koruma yapılmasıdır.
1. Uygun Metal Seçimi : Metal seçimi, işin rantabilitesi ile ilgili olduğu için her yeraltı ve sualtı yapısı için özel alaşımların kullanılması beklenemez. Bu nedenle bu yolla korozyondan korunmak her zaman mümkün değildir.
Yer altı suyu temini için açılan sondaj kuyularında kullanılan filtre boruları değişik zemin, sıcaklık ve kimyasal içeriği değişik su katmanlarını kestikleri için korozyona uğrama ihtimalleri de oldukça fazladır.
% 18 den fazla krom, % 8 den fazla nikel, % 72 kadar demir, 0,08 den az karbon içeren 304 paslanmaz çeliği de kuyu filtresi olarak güvenilir bir alaşımdır. Ancak çözünmüş oksijen muhtevasının normalin üzerinde olduğu bilinen akiferlerde paslanmaz çelik kuyu filtrelerinin kullanılması uygundur.
2. Koruyucu Kaplamalar : Korozyondan korunmak için metalin koruyucu kaplamalar ile kaplanarak çevre ile yapı arasında az veya çok yalıtkan bir engel oluşturmak daha ekonomik bir yoldur.
Kaplamaların kalitesi elektriksel dirençleri ile ilgili olup, 10000 ohm / mm2 den büyük dirençliler korozyon açısından uygundur.
Kaplamalar malzemelerine göre :
a) Metalik
b) Organik
c) İnorganik
olmak üzere 3 gruba ayrılabilirler. Bu kaplamaların hangisinin seçileceği, korunacak metalin cinsine, biçimine, boyutuna ve çevre etkilerine ve de şüphesiz ekonomik şartlara bağlıdır. 1977 yılında Adana - Ceyhan BOTAŞ Bölge Müdürlüğünün DSi F-31/ 20578 Nolu kuyusundan beslenen bitüm benzeri bir izolasyon maddesi ile kaplı, 17 mm lik 8" kapalı çelik boru ile yine kapalı bir su tankına verilen suyun, bu maddenin suda çözünmesi sonucu kesif H2S yayımına neden olduğu yapılan incelemeyle tespit olunmuş ve şebeke hatalı kaplama nedeniyle iptal edilmiştir.
Kaplamalarda Kullanılan Malzemeler
Metalik kaplamalar : Demiri kaplamak için kullanılan metallerin başında çinko gelir. Daha sonra nikel, kalay, kadmiyum, kurşun ve alüminyum kullanılır.
Organik kaplamalar : Asfaltik boyalar, maden kömürü zifti, epoksi resin boyaları, klorlanmış sert plastik, polietilen kullanılır.
İnorganik kaplamalar : Asit, baz gibi kimyasal maddelerin taşınmasında inorganik enamel kaplamalar uygundur. Genellikle feldspat, kaolin, boraks, soda ve litarj karışımı kullanılır.
Enamal kaplamalar mükemmel kaplama özelliği vermelerine karşın, mekanik çarpmalarına ve sıcaklık değişmelerine karşı dayanıksızdır ve çabuk kırılabilir.
3. Kullanma Sularında Korozyonun İnhibitörle Önlenmesi
Kullanma sularında metallerin korozyonunun kontrolü zordur. Çünkü suya ancak bazı toksik olmayan maddeler, küçük dozlarda ilave edilebilir.
Avrupa'da bazı belediye dağıtım sistemlerinde korozyon önleyiciler kullanılmaktadır. Korozif sulara tatbik edildikleri zaman metalin yüzeyinde çözünmeyen çinko sülfat filmi teşekkül ederek koruma temin edilir.
Bu şekilde metaller bol havalı yumuşak atmosfer sularından çok fazla çözünmüş madde içeren çeşitli sulara karşı korunabilirler.
İnhibitör (önleyici) bileşimleri : 3 mol çinko sülfat, 2 mol sülfamik asit ve 2 mol mono sodyum ortofosfattan meydana gelen karışım önleyici olarak iyi neticeler vermiştir.
3 ZnSO4 + 2 HNH2SO3 + 2 NaH2PO4 à Zn3(PO4)2+ 2NaNH2SO3+ 3H2SO4
484,32 194,20 240,0 386,10 238,18 294,12
Aşağıdaki karışım 50 Ib (22679.59 gr) 1 milyon gal.(3,7.106 litre) suya ilave edildiğinde 1,2 ppm çinko dozajı elde edilir.
ZnSO4.H2O 27,65 lb 12541,81 gr
HNH2SO3 10,00 lb 4335,92 gr
NaH2PO4 12,35 lb 5601,86 gr
50,00 lb 22679,59 gr
Önleyici çözeltinin fiziksel karakteristikleri :
Renk Renksiz
Baume 45.2 (20 °C)
pH 1,0 (20 °C)
İnhibitör dozajı :
Korozif suya başlangıçta 2 - 3 ppm çinko tatbik edilmelidir. Dağıtım sisteminin muhtelif noktalarına bu dozaj tatbik edilir.
Her yerde bu konsantrasyona ulaşıldığı an dozaj devamlı 1 ppm temin edilecek şekilde indirilir. Dağıtım sistemini pasifleştirmek için başlangıç dozajı verildikten sonra geçecek zaman 3 hafta olarak hesaplanmıştır.
Bazı yüksek alkali sularda kalsiyum karbonatın çökmesini önlemek için 0,5 - 1,0 ppm sodyum hexameta fosfat ilavesi gerekebilir. Kalsiyum karbonat çökmesi çinko fosfat tabakasının koruyucu özelliklerini zayıflatır ve korozyon önleyici tesirini bozar. Emniyet : Kaliforniya eyaleti Sağlık Bakanlığı kullanma suları için çinko dozajını 2 ppm veya daha küçük kabul etmiştir. Long Beach (California) şehri dağıtım sisteminde iki senelik tatbikattan sonra 1 ppm dozajın mide, barsak ve diğer suyla ilgili hastalıklara yol açmadığı görülmüştür.(1970)
06. Kalsiyum Karbonat Birikimi ile Korozyon Kontrolü
Kalsiyum karbonat çöktürülmesi ile korozyon kontrolü pratikte kullanılan çok yaygın bir metoddur. Koruyucu CaCO3 tabakasının oluşturulması için gerekli hesaplar, kaplama tekniği ve uygulama zor değildir. Korozyon kontrol problemleri Caldwell-Lawrence diyagramları kullanılarak çözümlenebilir. Ham suyun durum, tip, koruma için gerekli kimyasal madde miktarı ve boruda birikecek CaCO3 miktarı diyagramlardan bulunabilir.
Kimyasal Reaksiyonlar : Bu reaksiyonlar sistemindeki ana bileşenler su, karbondioksit, karbonik asit, hidrojen iyonu, hidroksit, bikarbonat ve kalsiyumdur. Bazı şartlarda Ca ve CO3 arasındaki reaksiyon sonucu CaCO3 çökebilir.
Ca++ + CO3à CaCO3
Çökme Ca ve karbonat konsantrasyonları çözünürlük çarpımını aştığı anda olur. Koruyucu sular olarak isimlendirilen sular da CaCO3 çökerek koruyucu bir film tabakası oluşturur. Başka bir deyimle bir suyun bir tabaka oluşturabilmesi için (Ca)(CO3) değerinin çözünürlük çarpımı değerinden fazla olması gerekmektedir. Aksi halde çökme olmaz. CaCO3 değerinin doygunluğun altında olduğu hallerde su koruyuculuk özelliği göstermez ve bu sularda genellikle korozyon hızlıdır.
(Ca)(CO3) değerinin çözünürlük çarpımına eşit olduğu hallerde su doygundur. Bu doygunluğu sağlayan bilgileri aşağıdaki gibi özetleyebiliriz.
1. Suyun doygunluğunun tespiti
2. Elde edilecek aşırı doygunluk derecesinin seçimi
3. Kullanılacak kimyasal maddelerin tiplerinin ve şartlarının seçimi
4. Arzu edilen aşırı doygunluğu sağlayacak miktarda kimyasal madde katılması
5. Çökme ile oluşacak CaCO3 miktarının tayini
Bu faktörlerin tayininde kullanılan teori ve matematiksel işlemler oldukça kompleks olmakla beraber Caldwell ve Lawrence in ortaya koyduğu diyagramlar bu işe çok basit çözüm yolu getirmiştir.
Borudan geçen suyun özellikleri : Metalik korozyon elektro kimyasal bir reaksiyon olup metal ve metalin temasta bulunduğu suların meydana getirdiği elektrik akımı neticesi oluşur. Metal ve suyun temasta bulunduğu yüzeyde oluşturulacak film tabakası yoğun kopmaz ve düzgün bir şekilde oluşturulmuş olmalıdır. Aşırı doymuş suda aşağıdaki özellikler yerine geldiğinde böyle bir film tabakası oluşabilir.
1. Su CaCO3 ile aşırı doymuş olmalıdır. Bu aşırı doygunluk sınırı 4 - 10 mg / lt CaCO3, yani teorik çökme potansiyeli 4 - 10 mg / lt olmalıdır.
2. Kalsiyum ve alkalinite değerlerinin her biri en az 40 mg / lt (CaCO3) veya ekonomik ise daha fazla olmalıdır. Her iki değerin yaklaşık eşit konsantrasyonlarda olması gerekir.
3. Alkalinite / klorür + sülfat oranı en az 5 : 1 olmalıdır.(Bütün konsantrasyonlar mg / lt CaCO3 olarak)
4. pH 6,8 - 7,3 aralığında olmalıdır.
5. Su hızı 0,6 m / s den fazla olmalıdır.
Bu şartlardan bazıları ortak olarak (karşılıklı) hariç bırakılabilir, birisi diğerinin hesabına alınabilir. 1, 2 veya 3 şartlarının en önemlisi olduğuna ve korunması gerektiğine inanmışlardır. Pratik olarak 4 şartı tasfiye edilmemiş suyun başlangıçtaki kalsiyum ve alkalinitesi yüksek olduğuna korunabilir. Ekonomik nedenlerle tasfiye sırasında düşük Ca ve düşük alkaliniteli suların pH ı 8,0 veya daha büyük yapılır. Bu pH larda meydana gelen CaCO3 filmi daha az koruyucudur. Fazla pH değerinden kaçınılmalıdır.
07. Caldwell - Lawkence Diyagramları
Caldwell-Lawrence diyagramları CaCO3 dengesi ile ilgili problemlerin çözümünde kullanılır. Diyagramda gösterilen bütün konsantrasyonlar çözülebilir bileşenleri gösterir. Her diyagram verilen sıcaklık ve toplam çözünmüş madde içindir. Örneğin 25 °C ve 40 mg / lt toplam çözünmüş maddeye ait diyagramdan alınan sonuçlar diğer şartlar için geçerli değildir. Bununla birlikte pratik olarak incelenen suyun bulunduğu şartlar diyagramdakine yakınsa kullanılabilirler. Bütün sıcaklık ve toplam çözünmüş madde ikilisi için diyagram yapmak pratik olmadığından bazı kabuller yapılarak diyagramlar kullanılmalıdır. 2, 5, 15 ve 25 °C sıcaklık ve onlara bağlı 40, 400 ve 1200 mg / lt toplam çözünmüş madde için diyagramlar verilmiştir.

Caldwell - Lawrence diyagramlarında (yukarıda) kalsiyum, alkalinite ve pH değerleri vardır. Diyagram karışık görünmesine rağmen kullanılması kolaydır. Diyagramdaki bazı terimler aşağıdaki şekilde tanımlanabilir. konsantrasyon : mg / lt CaCO3 olarak veya mg / lt CaCO3 . Aksi söylenmedikçe bütün miktarlar mg / lt CaCO3 olarak verilir. Bu şekilde uygunluk sağlanır. İkisi de CaCO3 mg / lt olarak verilmiş olan bir madde diğer bir mg / lt olan bir madde ile tamamen reaksiyona girer. Bu şekilde her sefer kimyasal eşitlik ve reaksiyonun düşünülmesine gerek kalmaz. Örneğin 25 mg / lt Ca hidroksit CaCO3 olarak, 25 mg / lt HCO3 la CaCO3 olarak veya 25 mg / lt CO2 ve 25 mg / lt CO3, CaCO3 olarak reaksiyona girer. pH : Sıcaklık düzeltmeli pH metreden okunur.
Toplam çözünmüş madde : C-L diyagramlarında eğrilerin şekillerini etkiler. Toplam çözünmüş madde, suyun tam analizi yapılarak hesap edilir. Bazen numune kuruluğa kadar buharlaştırılıp kalıntı ağırlığı alınır. Burada toplam çözünmüş maddeler CaCO3 olarak verilmeyip mg / lt olarak verilmiştir.
Sıcaklık : Sıcaklık eğrilerin şekline çok fazla etki eder. Bu nedenle hesap yapılacak suyun sıcaklığı ile kullanılan diyagramdaki sıcaklık arasında birkaç dereceden fazla olmamalıdır.
C = (F - 32) : 1,8
C : Centigrad derecesi
F : Fahrenheit derecesi
Alkalinite : Alkalinite asidi nötralize etme kapasitesidir. Metil oranjla pH 4,5 a yakın suyu kuvvetli asitle titre ederek bulunur.
Alk = HCO3 + CO3 + OH + H + ... (3)
Bu eşitlikteki miktarlar kalsiyum karbonat olarak mg litre verilmiştir. Alkelinite önemli bir su kalite parametresidir. Kimyasal katma veya çökme sonucu alkalinitedeki değişmeler basit olarak şu şekilde hesaplanabilin :
Alk son = Alk Başlangıç + Alk Katma Alk Çökme (4)
Kimyasal katma ve çökme sonucu alkalinitedeki değişimler aşağıdaki örnekte verilmiştir.
ÖRNEK 1 : Başlangıç alkalinitesi 15 mg / lt olan su 30 mg / lt sodyum karbonatla muameleden sonra 5 mg / lt CaCO3 çökelmesi yapmıştır. Çözeltinin alkalinitesi nedir? (Toplam çözünmüş maddeden başka hepsinde CaCO3 olarak mg / lt kullanılmıştır)
1. Alk Başlangıç = 15 mg / lt
2. Alk Katma = 30 mg / lt , 3 eşitliği katılan CO3 kadar alkalinitenin arttığını göstermektedir. Na2CO3 şeklinde 30 mg / lt CO3 katılmıştır. Bu nedenle alkalinitede 30 mg / lt artar.
3. Alk Çözelme = 5 mg / lt Çözeltiden 5 mg / lt CaCO3 ayrılmıştır. 3 eşitliğine göre alkalinlte aynı miktarda azalır.
4. 4 eşitliğinden Alk Son = 15 + 30 5 = 40 mg / lt
Alkalinitenin ikinci bir özelliği sıcaklığa bağlı olmamasıdır. Verilen bir sıcaklıkta ölçülen alkalinite, suyun sıcaklığı düşürüldüğünde veya yükseldiğinde CaCO3 çökmesi olmadığı zaman değişmez. Böylece , laboratuvar sıcaklığında bulunan alkalinite numunenin alındığı nehrin sıcaklığında bulunan alkalinite ile aynıdır. Bununla birlikte ısınma sırasında CaCO3 çökerse 3 ve 4 eşitliğindeki gibi alkalinite değişir.
ÖRNEK 2 : Nehirden alınmış suyun sıcaklığı 2 °C, alkalinite analizi yapılacak Laboratuvar sıcaklığı 25 °C ise ve ısınma sırasında
CaCO3 çökmesi olmuyorsa, alkalinite 25 mg / lt bulunmuşsa, suyun 2 °C deki alkalinitesi 25 mg / lt dir.
Asitlik = C-L diyagramında asitlik düşey eksenlere işaretlenmiştir. Asitlik suyun bazikliğini nötralleştirme kapasitesi olarak ölçülür.
Asitlik : CO2 + H2CO3 + HCO3 + H-OH ------ (5)
bütün miktarlar CaCO3 olarak mg / lt dir. Asitlik pozitif olduğu gibi negatif de olabilir. Sıfır işaretli yerin üstünde değerler pozitif, altındakiler negatiftir. Asitlik alkalinite gibi sıcaklıkla değişmez. Ancak ısıtma ve soğutma sırasında atmosferle CO2 alışverişi olmaması gerekir. Başlangıç eşitliği, katılan kimyasal madde ve çöken madde miktarları bilindiğinde 6 eşitliğinden son asitlik hesaplanabilir :
Asitlik Son = Asitlik Başlangıç + Asitlik Katılan - Asitlik Çökme
Bundan başka CaCO3 çökmesi veya çözünmesi sırasında da asitlik değişmez. Bu özellik C-L diyagramlarında CaCO3 ve çözünmesinin izlenmesini kolaylaştırır. Örnek 3 de kimyasal katma ve çökme ile eşitlikte olan değişim verilmiştir.
ÖRNEK 3 : Kireç katılmış numunenin eşitliği 200 mg / lt dir. 60 mg / lt CO2 katılmasıyla 45 mg / lt CaCO3 çökme olmaktadır. Son asitlik ne olur ?
1. Asitlik Başlangıç = 200 (Verilmiş)
2. Asitlik Katılmış = 60 mg / lt CO2 : 5 eşitliği asitliğin katılan CO2 kadar arttığını gösterir.
3. Asitlik Çökmüş = O, CO3 , CaCO3 la çökmüştür, fakat 5 eşitliğinde CO3 terimi olmadığından asitlik çökmesi yoktur.
4. 6 eşitliğinden, Asitlik Son = - 200 + 60 - 0 = - 140 mg / lt pratikte titrasyon sonunun tayini zor olduğundan asitlik çoğu kez ölçülmez. Bununla birlikte alkalinite ve pH bilindiğinde asitlik hesaplanabilir. C - L diyagramlarından suyun asitlisini bulmak için ölçülen pH ve alkalinite değerlerinin kesişme noktasından yatay bir çizgi çizilir, dikey (asit) eksenini kestiği nokta alınır. Yatay eksen, C2 : Yatay eksen C2 aşağıdaki gibi tarif edilmiştir :
C2 = Alk - Ca = HCO3 + CO3 + - H - Ca ........ (7)
CaCO3 çökelmesi ve çözünmesi sırasında CO3 ve Ca aynı miktarda değişir. C2 değişmez. Bu şekilde CaCO3 çökme ve çözünmesi CL diyagramlarından kolayca bulunabilir, çünkü dikey olarak sabit C2 çizgisi üstünde hareket ederler. Herhangi bir suyun C2 değerini bulmak için suyun kalsiyum ve alkalinitesinin kesim noktasından dikey çizilir. Yatay C2 eksenindeki kesim noktası alınır.
Yön Vektörleri ve pH-Mg nomografi : Suyun yumuşatılma hesaplarında yukarıdaki sekilin üst köşesindeki yön vektörleri ve sol alt köşedeki pH - Mg nomografi kullanılır. Korozyon kontrol problemlerinde kullanılmaz.
08. C - L Diyagramlarının Kullanılması
Referans olarak yukarıdaki şekil kullanılarak bazı korozyon kontrol problemleri çözülebilir. Suyun doygunluk hali ölçülmüş kalsiyum alkalinite ve pH değerinden bulunur. Eğer eğriler bir noktada kesişiyorlarsa su tam doygundur.
1. Sıcaklık : 15 °C
2. Toplam çözünmüş madde : 96 mg / lt
3. pH : 8,6
4. Kalsiyum : 70 mg / lt
5. Alkalinite : 37 mg / lt
15 °C sıcaklık için birçok diyagram vardır. Örneğin toplam çözünmüş madde 40 mg / lt ve 400 mg / lt için diyagramlar vardır.
96 mg / lt , 40 mg / lt ye yakın olduğundan pratikte bu diyagram kullanılmalıdır. 40 mg / lt ve 400 mg / lt diyagramları kullanılarak interpolasyonla daha doğru sonuç alınabilir.
25 °C ve toplam çözünmüş madde (40 mg / lt) diyagramları kullanılarak pH 8,6 , Ca 70 ve alkalinite 37 işaretlenir. Üç çizgi de tek bir nokta, A noktasında kesişmektedir. Böylece su tam doygundur. Aşırı doygun veya doygun olmayan sularda ise çizgiler bir noktada kesişmez, fakat bir zarf şekli meydana getirirler.
ÖRNEK 5 : Aşağıda verilmiş suyun saturasyon durumunun bulunması,
1. Sıcaklık : 15 °C
2. Toplam çözünmüş madde :115 mg / lt
3. pH : 9,5
4. Ca : 28 mg / lt
5. Alkalinite : 70 mg / lt
15 °C ve 40 mg / lt toplam çözünmüş madde için yukarıdaki şekilde 4 örneğinde olduğu gibi kalsiyum, alkalinite ve pH çizgileri işaretlenir. Sonra kesim noktaları birleştirilir. Bu su için nokta yerine BCD zarfı oluşmuştur. Onun için su doygun değildir, fakat doygunluk altında veya üstündedir. Bunu söylemek için aşağıdaki kural kullanılır. Eğer ölçülen kalsiyum değeri pH ve alkalinite çizgilerinin kesişmesinden bulunandan daha büyükse su doygunluğun üstündedir, eğer daha küçükse doygun değildir.
Bu örnekte, ölçülmüş kalsiyum değeri ( 28 mg / lt ), alkalinite ve pH çizgilerinin kalsiyum çizgisini kestiği (6 mg / lt) yi aştığı için doygunluk üstündedir. Çökme yaparak koruyucu CaCO3 tabakası oluşturulabilir.
Bu sudan teorik olarak ne kadar CaCO3 çökelir? Çökme sırasında, doygunluğun üstündeki su (aşırı doygun) kolaylıkla tutabileceğinden fazla olan Ca ve CO3 iyonlarını çökeltir. Bu noktadan sonra artık CaCO3 çökmesi olmaz. Aşırı doygun sudaki kalsiyum değeri ile doygun haldeki kalsiyum değeri arasındaki fark çökebilecek maksimum CaCO3 ı verir. Hesabı tamamlamak için C- L diyagramında doygunluk haldeki kalsiyum değeri bulunmalıdır.
Doygunluk hali bulunurken aşağıdaki faktörler kullanılır.
1. Asitlik CaCO3 çökmesi sırasında değişmemelidir.
2. C2 , CaCO3, çökmesi sırasında değişmemelidir.
ÖRNEK 6 : Örnek 5 deki suyun asiditesi pH ve alkalinite çizgilerinin kesiminde 56 mg / lt bulunmuştur.(Şekil de C noktası) C2 değeri 42 mg / lt ve asidite değerleri çökme sırasında değişmemiştir. Bu şekilde doygun su da başlangıçtakinin aynıdır. Asitlik ve C2 nin kesim noktası E doygun suyu gösterir.(Ca 17 , Alk 59 , pH 9,01) Diyagramdaki E noktasından bu doğrudan okunabilir. Aşırı doygun suda kalsiyum değeri (28 mg / lt) ile doygun suyun kalsiyum değeri (17 mg / lt) arasındaki fark çökebilecek maksimum CaCO3 (11 mg / lt) verir. Aynı miktar alkalinite ve kalsiyum çökmesi gerektiğine göre başlangıç alkalinitesi (70 mg / lt) ve doygun su alkalinitesi (59 mg / lt) arasındaki fark da çöken CaCO3 a eşittir. (11 mg / lt) Bu şekilde çöken kalsiyum ve çöken alkalinitenin eşit ligi çalışmanın doğruluğunun kontrolü için kullanılabilir.
09. Katodik Koruma
Katodik koruma ilk kez 1824 yılında Humphry Davynin bulduğu elektrokimyanın ilk mühendislik uygulamasıdır. Bu yöntemin ana prensibi, herhangi bir elektrolit içindeki bir metal yapının korunması gerekli bölümlerinin yapay olarak katot haline getirilmesidir.
Buraya kadar anlatılanlara göre borulardaki suyun yarattığı dahili korozyonun kontrolü için, aşağıdaki metotlardan uygulamaya gidilerek yapıla bilinir.
a. Oksijenin uzaklaştırılması
b. Serbest karbon dioksitin uzaklaştırılması
c. Koruyucu bir tabaka ile kaplamak
d. İç kısımları boya gibi pasif koruyucu ile kaplamak
e. Biyokimyasal faaliyeti önlemek için bilhassa dağıtım sisteminin ölçü uçlarında klorlama yapmak.
Suyun, korozif olup olmadığı Langeller Denge İndeksi Metodu ile tespit edilebilir. Bunun için sudaki Ca, CO3, HCO3 iyonlarının miktarı ile pH değerinin bilinmesi gereklidir.

 Korozyon
Korozyon
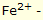 iyonları çözünmeye başlar. Bu çözünme sahası lokal bir anot gibi tesir eder (Lokal Anodu). Damlaların kenar bölgesinde, çözünen havanın oksijeninden oluşan OH- iyonları çözünen demir
iyonları çözünmeye başlar. Bu çözünme sahası lokal bir anot gibi tesir eder (Lokal Anodu). Damlaların kenar bölgesinde, çözünen havanın oksijeninden oluşan OH- iyonları çözünen demir 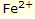 ile reaksiyona girer ve ilk önce demir hidroksit Fe (OH)3 ve buradan pas FeO(OH) oluştururlar. Pas, damlanın kenarında ring şeklinde ayrılır. Benek şeklinde başlayan pas oluşumu çelik yüzeylerde gözlenebilir. Korozyonun sürekli olarak devam etmesi halinde bütün çelik yüzeyleri bu yerlerinden itibaren paslanır.
ile reaksiyona girer ve ilk önce demir hidroksit Fe (OH)3 ve buradan pas FeO(OH) oluştururlar. Pas, damlanın kenarında ring şeklinde ayrılır. Benek şeklinde başlayan pas oluşumu çelik yüzeylerde gözlenebilir. Korozyonun sürekli olarak devam etmesi halinde bütün çelik yüzeyleri bu yerlerinden itibaren paslanır.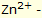 iyonları çözünmeye başlar. Her iki elektrot arasında büyüklüğü elektrot malzemelerine bağlı olan küçük bir elektrik gerilimi oluşur.
iyonları çözünmeye başlar. Her iki elektrot arasında büyüklüğü elektrot malzemelerine bağlı olan küçük bir elektrik gerilimi oluşur.
