helyum (He)
Sponsorlu Bağlantılar
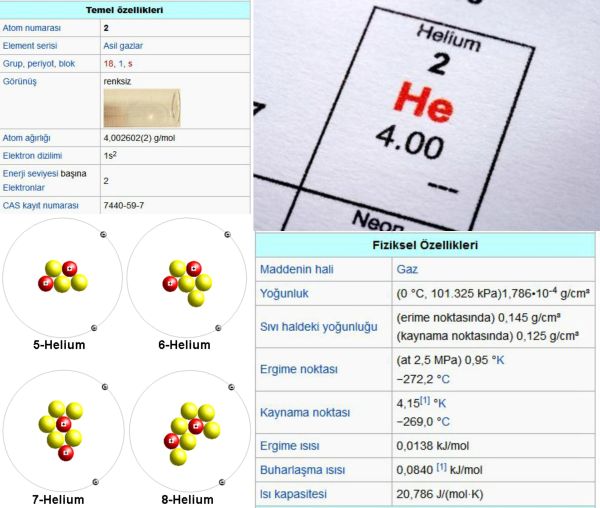
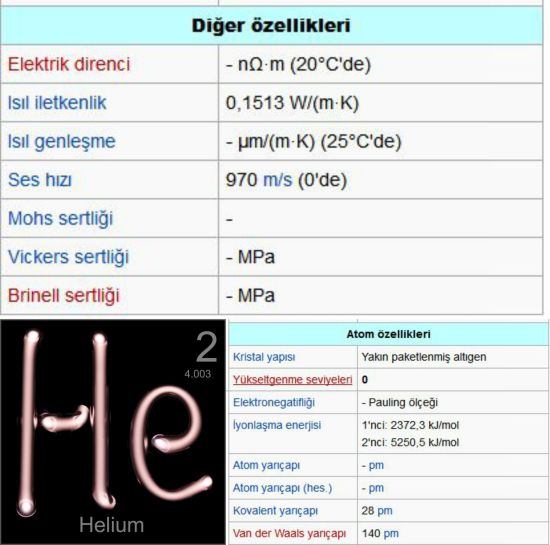
268,6°Cde sıvılaşır ve ancak yüksek basınç (y. 25 atmosfer) altında katılaşır. 2,17 Kin altında helyum-4 izotopu benzersiz özellikler kazanır: üstünakışkan durumuna geçer (ağdalılığı kaybolur) ve ısıl iletkenliği bakırınkinin bin katı olur. Bu durumdaki helyuma, normal akışkan helyum Iden ayırt edilebilmesi için helyum II adı verilir. Kimyasal olarak eylemsiz olan helyum, bileşikler oluşturmaz ve molekülleri tek atomdan oluşur.
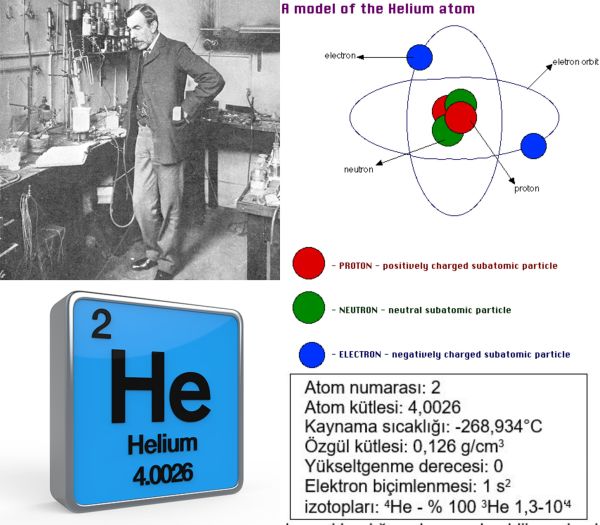
Helyumu 1868de, Güneşi çevreleyen gaz atmosferi üzerinde incelemeler yapan ve Güneş tayfında o güne değin bilinen herhangi bir elemente ait olmayan parlak çizgiler saptayan Pierre Janssen ve Joseph Norman Lockyer buldular ve adlandırdılar. 1895te de Sir William Ramsay helyumu, Yerden çıkartılan kleveyit mineralinde buldu; Ramsay, mineralin tayfında beliren parlak san çizginin, Güneş tayfında saptanan helyum çizgisiyle aynı olduğunu belirledi.
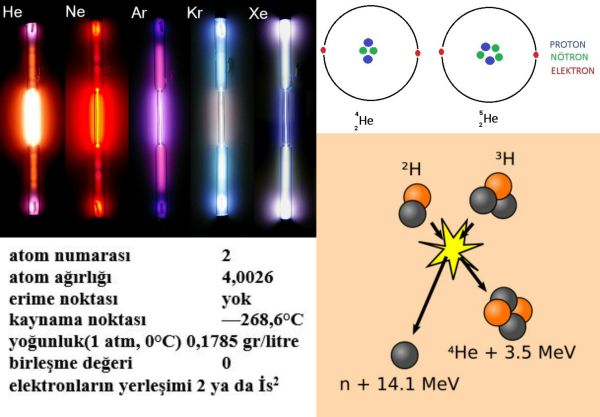
Evrende hidrojenden sonra en çok bulunan ikinci element olan helyum yıldızlarda yoğunlaşmış durumdadır ve burada hidrojenden çekirdek kaynaşması yoluyla ürer. Yer atmosferinin yalnızca yüzde 0,0005ini oluşturur ve demirli göktaşı (siderit) gibi bazı radyoaktif minerallerde ve mineral yataklannda az miktarlarda bulunur. Buna karşılık, ABDde, özellikle Texas, New Mexico, Kansas, Oklahoma, Arizona ve Utah ta çıkan doğal gazlarda yüzde 7,6ya ulaşan oranlarda helyuma rastlanmıştır. Kanada, eski Sovyetler Birliği, Güney Afrika ve Sahra Çölünde de bazı önemli helyum kaynakları bulunmuştur.
Helyum Yerde, radyoaktif bozunum süreçleri sonucunda oluşmuştur. Daha ağır radyoaktif maddelerin çekirdeklerinden salman alfa parçacıkları, helyum-4 izotopunun çekirdekleridir. Helyum, argon gazının tersine, atmosferde bol miktarlarda toplanmaz, Yerin kütleçekimi kuvvetini aşarak yavaş yavaş uzaya yayılır. Yerde eser miktarda bulunan helyum-3 izotopunun, yine ender rastlanan hidrojen-3 izotopunun (trityum) negatif beta bozunumu sonucunda oluştuğu sanılmaktadır. Bu nedenle Yerde bol miktarlarda bulunan helyum, iki kararlı izotopu olan helyum-4 (yüzde 99,99987) ile helyum-3ün (yüzde 0,00013) karışımından oluşur.
Yüzde 98,2 anlıktaki helyum gazı, doğal gazdan öteki bileşenlerin düşük sıcaklıkta ve yüksek basınç altında sıvılaştırtarak ay- nlması yoluyla elde edilir. Soğutulmuş ve etkinleştirilmiş odunkömüründen öteki gazlann soğurulması yöntemiyle de yüzde 99,995 anlıkta helyum elde edilebilir. Helyumdan, alüminyum gibi metallere örtülü kaynak yapılırken eylemsiz gaz atmosferi olarak yararlanılır. Aynca roketlerde, özellikle sıvı hidrojenli yakıt tanklarının basıncının artınlmasında kullanılır, çünkü sıvı hidrojen sıcaklığında helyum gaz halini korur. Sıvı helyum, en soğuk madde olduğundan kriyojeni (düşük sıcaklıklar fiziği) alanında da önem taşır. Helyumun kandaki çözünürlüğü çok düşüktür; bu nedenle, yüksek basınçlı ortamlarda, örneğin tüple dalışlar sırasında ya da kesonlu inşaat çalışmalarında rahat solunum sağlamak amacıyla, oksri jenle karıştırılmış helyumdan yararlanılır. Göktaşları ve kayaçlar helyum içeriği bakımından çözümlenerek tarihlendirilirler.
helyumla tarihleme
uranyum-235, uranyum-238 ve toryum-232 radyoaktif izotoplarının bozunumu sırasında helyum oluşumuna dayalı tarihleme yöntemi. Bu bozunum nedeniyle, helyum tutabilecek herhangi bir mineralin ya da kayacın helyum içeriği zamanla artar, böylece helyumun kendisinden önceki radyoaktif maddelere oranından jeolojik zamanın ölçülmesinde yararlanılır. Eğer kaynak izotoplar ölçülürse yöntem, uranyum-toryum-helyumla tarihleme olarak; yalnızca alfa parçacığı salımı ve helyum içeriği ölçülürse, alfa-helyum radyoaktif saati olarak adlandırılır. Alfa parçacıkları, kaynak izotopların çekirdeğinden salman helyum atomu çekirdekleridir.
İzotop jeokronoloj isinde kütle spektrometresi (tayfölçüm) tekniği uygulanmadan önce, jeolojik zaman ölçeklerinin hazırlanmasında temel olarak helyumla tarihleme yönteminden yararlanılırdı. Ama helyum kayaçlardan önce atmosfere, sonra da evre ne sızdığından, bu teknikle çok eskilere giden tarihlemelerin yapılması olanaklı değildir. Öte yandan radyoaktif saatleri etkisiz kılan ısıl olaylar, helyum radyoaktif saatlerini de olumsuz yönde etkiler. Gene de helyumla tarihleme tekniğinin, Senozoyik (Yakın) Zamanın sonları ile Pleyistosen Bölümde (y. 2,5 milyon-10 bin yıl önce) oluşan kayaçların ve minerallerin jeolojik yaşının belirlenmesinde etkili olacağı düşünülmektedir; çünkü bu kay açlar ve mineraller daha öncekiler gibi karmaşık süreçlerden geçmemiştir ve bu nedenle içerdikleri helyumun tümünü korumakta oldukları sanılmaktadır. Mineraller ve kay açlar gibi fosiller de helyumla tarihlenebilir.
kaynak: Ana Britannica
Son düzenleyen Safi; 22 Eylül 2019 00:35

 Elementler - Helyum
Elementler - Helyum