Molekül Yapısı (Moleküler Yapı)
Atomlar belirli kurallar çerçevesinde belirli geometrik düzende birleserek molekülleri olustururlar. Moleküller için çesitli açiklamalar yapabilmek için öncelikle molekülün yapisini bilmemiz gerekmektedir.
Degerlik Elektron Sayisi (DE)
Atomlarin en son kabugundaki toplam elektron sayisidir. Bu elektronlar çekirdege daha uzak oldugu için koparilmalari daha kolaydir ve tepkimelerde degisiklige ugrayan elektronlardir. N (azot) atomunun degerlik elektronu 5 tir (2s22p3).
Örnegin atom numarasi 7 olan N (azot)'un un elektron dagilimi su sekilde olur.
7N
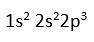
N atomunun degerlik elektronu 5 tir (
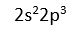
).
Sekilde de görüldügü gibi p orbitallerinin elektronlari tek tek yerlestirilir.
20Ca atomunun ise elektron dagilimi (DE)
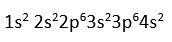
seklindedir. Ca atomunun degerlik elektronu 2 dir (
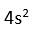
).
6C elektron dagilimi
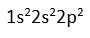
C atomunun degerlik elektronu 4'tür (
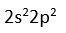
)
Geçis elementlerinde (n-1) d orbitalindeki elektronlarda degerlik elektronlarina eklenir.
23V 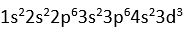
23V nin degerlik elektronu 5'tir (
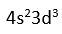
)
Lewis Kurali
Soygazlar son kabuklarinda sekiz elektron bulundururlar. Yani degerlik elektron sayisi sekizdir ve karali bir yapilari vardir. Atomlarda periyodik tabloda kendine en yakin soygaza benzemek için elektron alisverisinde bulunurlar veya elektronlarini bag yapacaklari diger atom ile ortaklasa kullanirlar. Atomlarin son kabuklarinda bulunan elektronlar 4 taneden azsa önce bunlar teker teker yerlestirilir. 4 ten sonraki elektronlar ise eslesmemis elektronlarin yanina eslestirilir.
8O 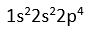
Degerlik elektron sayisi 6 (
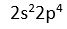
) . 6 elektoronun 4 tanesi teker teker yerlestirilir. Kalan 2 elektronda tek elektronlarin yanina yerlestirilir.
Asagidaki nokta yapisindan O (oksijen) atomunun 2 tane ortaklanmamis elektronu 2 tanede bag yapmakta kullanabilecegi elektronu oldugunu görüyoruz. Yani O atomu 2 bag yapabilir.
Moleküllerin Lewis Yapisinin Belirlenmesi
H2O molekülü örnek alinarak moleküllerin lewis yapisini açiklayabiliriz.
1. Moleküldeki toplam degerlik elektronlari hesaplanir.
1H
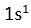
Degerlik elektronu (DE) 1 ( 2 tane H atomu oldugu için 2x1=
2 )
8O 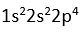
Degerlik elektronu
6 DE = 6+2 = 8
2. Molekülün oktet kuralina uymasi için gerekli elektron sayisi bulunur (OK).
Molekülde kaç tane H atomu varsa 2 ile çarpilir. Diger atomlar 8 çarpani ile çarpilir.
OK = 2 x 2 ( 2 H atomu var) + 8 x 1 (1tane O atomu var) = 12
3. Molekülün bag elektronlari bulunur.
BE = TDE - OK
BE = 12 8 = 4
4 tane elektron bag yapmak için kullanilacak. Buda molekülde 2 tane bag oldugunu gösterir (her bir elektron çifti bir baga karsilik gelmektedir).
4. Moleküldeki bag yapmayan yani ortaklanmamis elektronlar bulunur (OE).
OE = DE BE
OE = 8 4 = 4
5. Eger yapida H atomu varsa bunlar uçlara yerlestirilir. Yoksa (+) pozitif yüklü iyon ortaya koyulur. Moleküller arasinda önce baglar yerlestirilir.
Eger yapida artan bag kalirsa tekli baglarin yanina çift bag olarak yerlestirilir.
6. Bag yapmayan elektronlar atomlarin çevresine okteti saglayacak sekilde yerlestirilir. H atomunun oktet kuralina göre 2 elektronu diger atomlarin ise 8 elektonu oldugu unutulmamalidir.
O atomunun 2 tane bag elektronundan gelen toplam 4 tane elektronu vardir. Geriye oktet kuralini tamamlamasi için 4 elektrona ihtiyaci vardir.
Formal Yük
Formal yük = Grup numarasi ' OE - BS
Formal yük O için = 6 - 4 -2 = 0
Formal yük H için = 1- 0 1 = 0
Bulunan formal yükler atomlarin üzerine yazilir.
VSEPR Kuralı
Moleküldeki bag elektronlari ve ortaklanmamis elektronlar birbirlerini iterler. Elektronlar, atomlar etrafina bu itmeyi minimuma getirecek sekilde yerlestirilirler. Bunun sonucunda da moleküller kendilerine özgü geometrik sekiller olustururlar.
Bir
X atomuna
2 tane baska atom baglandiginda arada 2 tane bag olusur. Her bag, bir elektron çifti içermektedir. Baglar arasi itme kuvveti az oldugundan yapi düzlemseldir. Baglar arasindaki açi 180° dir. Örnek olarak
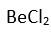
molekülü verilebilir.
Bir
X atomuna
3 tane baska atom baglandiginda arada 3 tane bag olusur. Her bag, bir elektron çifti içermektedir. Baglar arasindaki açi 120° olup yapi düzlem üçgen seklindedir. Bu yapiya örnek olarak
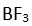
verilebilir.
Eger yapi
XY2 seklinde olup birde ortaklanmamis (bag yapmayan) elektron çifti varsa molekül V seklini alir ve aradaki bag açisi yine 120° dir. Bu duruma örnek olarak
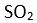
verilebilir.
Bir
X atomuna
4 tane baska atom baglandiginda arada 4 tane bag olusur. Her bag, bir elektron çifti içermektedir. Baglar arasindaki açi 109,5° olup yapi tetrahedral (dört yüzlü) seklindedir. Bu yapiya en güzel örnek
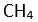
verilebilir.
Eger yapi
XY3 seklinde olup birde ortaklanmamis (bag yapmayan) elektron çifti varsa bu elektronlar bag elektronlarini itecegi için bag açisi azalir ve aradaki bag açisi yine 107° dir. Bu yapiya en güzel örnek

(amonyak) tir.
Eger yapi
XY2 seklinde olup yapida
2 tane ortaklanmamis (bag yapmayan) elektron çifti varsa bu elektronlar bag elektronlarini itecegi için bag açisi azalir ve aradaki bag açisi yine 104,5° dir. Bu yapiya en güzel örnek
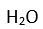
(su) dur.
Bir
X atomuna
5 tane baska atom baglandiginda arada 5 tane bag olusur. Her bag, bir elektron çifti içermektedir. Baglar arasindaki açi 120° ve 90° olup yapi üçgen çiftpiramit seklindedir. Bu yapiya örnek olarak
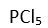
verilebilir.
Eger yapi
XY4 seklinde olup birde ortaklanmamis (bag yapmayan) elektron çifti varsa molekülün yapisi asagidaki gibi olur. Bu yapiya örnek olarak
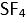
verilebilir.
Eger yapi
XY3 seklinde olup
2 tanede ortaklanmamis (bag yapmayan) elektron çifti varsa molekülün yapisi asagidaki gibi olur. Baglar arasindaki açi 90° dir Bu yapiya örnek olarak
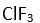
verilebilir.
Eger yapi
XY2 seklinde olup
3 tanede ortaklanmamis (bag yapmayan) elektron çifti varsa molekülün yapisi asagidaki gibi olur. Baglar arasindaki açi 180° dir . Bu yapiya örnek olarak
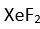
verilebilir.
Bir
X atomuna
6 tane baska atom baglandiginda arada 6 tane bag olusur. Her bag, bir elektron çifti içermektedir. Baglar arasindaki açi 90° olup, yapi oktahedral (sekizyüzlü) seklindedir. Bu yapiya örnek olarak
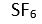
verilebilir.
Eger yapi
XY5 seklinde olup
1 tanede ortaklanmamis (bag yapmayan) elektron çifti varsa molekülün yapisi asagidaki gibi olur. Bu yapiya örnek olarak
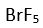
verilebilir.
Eger yapi
XY4 seklinde olup
2 tanede ortaklanmamis (bag yapmayan) elektron çifti varsa molekülün yapisi asagidaki gibi olur. Bu yapiya örnek olarak
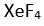
verilebilir.
BAKINIZ
Molekül Nedir? Moleküller ve Özellikleri Hakkında Genel Bilgiler
Kimyasal Bağlar ve Hibritleşme
Kimyasal Formül (Moleküler Formül)