Ziyaretçi
molekül
birbirlerine sıkı biçimde bağlanarak kararlı bir bütün oluşturan ve tek bir birim gibi davranan atom grubu.
Sponsorlu Bağlantılar
Molekül, katışkısız bir maddenin bütün kimyasal özellikleri ve bileşimi aynı kalacak biçimde bölünebileceği en küçük birimidir. Molekül parçacığı bölündüğünde ortaya çıkan daha küçük bölümlerin bileşimi ve kimyasal özellikleri çoğunlukla maddeninki- lerden farklıdır. Bu en son bölünmede moleküldeki atomları bir arada tutan kimyasal bağlar kırılır.
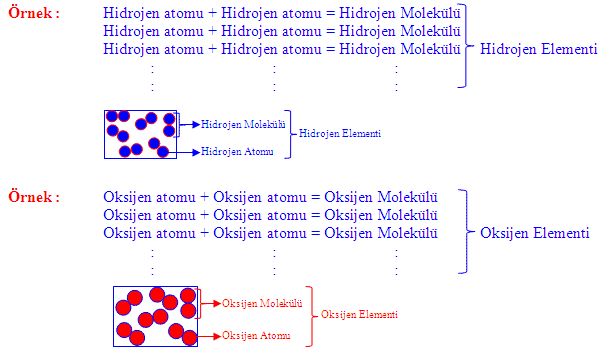
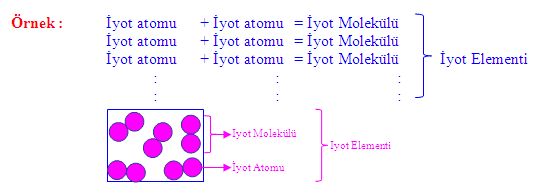
Atomlar artı yüklü bir çekirdek ile bunun çevresini saran eksi yüklü bir elektron bulutundan oluşur. Atomlar birbirine yaklaştığında elektron bulutları birbirleriyle ve çekirdeklerle etkileşime girer. Eğer bu, sistemin toplam enerjisini düşürecek bir etkileşim ise, atomlar birbirine bağlanarak bir molekül oluştururlar. Bu nedenle yapısal olarak herhangi bir molekül tek bir atomdan (helyum[He] molekülü ya da öbür asal gaz moleküllerinde olduğu gibi) ya da değerlik (valans) kuvvetleriyle bir arada tutulan bir atom yığışımından oluşabilir. Kimyasal olarak bağlanmış iki atomdan oluşan moleküllerde ise, eğer atomların her ikisi de aynı türden ise (örn. oksijen [O2] molekülü), bu tür bir moleküle eşçekirdekli (homonükleer) ikiatomlu molekül; eğer farklı türden ise (örn. karbon monoksit [CO] molekülü) buna da karmaçekirdekli (heteronükleer) ikiatomlu molekül denir. Karbon dioksit (CO2) ve su (H2O) molekülü gibi ikiden çok atomdan oluşan moleküllere çokatomlu molekül denir. Polimer molekülleri ise binlerce atomdan oluşabilir.
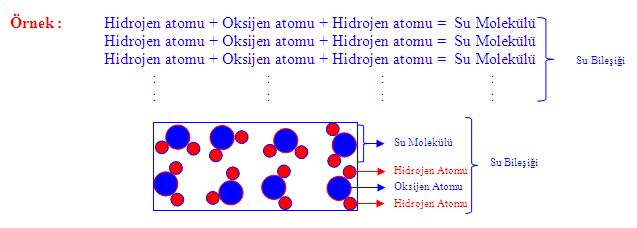
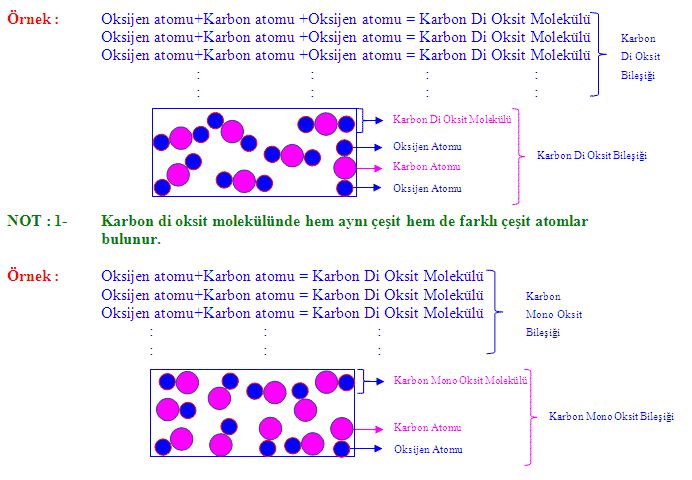
Bir molekül oluşturmak üzere bağlanan atomların sayılarının birbirine oranı sabittir; örneğin, her su molekülü bir oksijen atomu ile iki hidrojen atomundan oluşur. Kimyasal bileşikleri çözeltilerden ve öteki mekanik karışımlardan ayırt eden özellik budur. Bu nedenle örneğin, hidrojen ve oksijen mekanik bir karışımda herhangi bir oranda bulunabilir; ama tepkimeye girdiklerinde bir kimyasal bileşik olarak suyu (H2O) oluşturmak için ancak belirli oranlarda birleşirler. Aynı atomların farklı ama gene belirli bir oranda birleşerek farklı bir molekül oluşturması da olasıdır. Örneğin iki hidrojen atomunun iki oksijen atomuna kimyasal olarak bağlanmasıyla bir hidrojen peroksit (H2O2) molekülü oluşur. Dahası, atomlar özdeş oranlarda da birleşip farklı moleküller oluşturabilirler. Bu moleküllere izomer denir; bunlarda yalnızca molekül içindeki atom düzenlenişi farklıdır. Örneğin etil alkol (CH3CH2OH) ve metil eter (CH3OCH3) moleküllerinin her ikisi de bir oksijen, iki karbon ve altı hidrojen atomu içermekle birlikte, bu atomlar her iki birleşikte farklı biçimde bağlanmıştır.
Her madde belirgin molekül birimlerinden oluşmayabilir. Örneğin sofra tuzu olarak bilinen sodyum klorür bir kristal örgüsü biçiminde düzenlenmiş sodyum ve klorür iyonlarından oluşur; örgüdeki her sodyum iyonu eşit uzaklıktaki altı klorür iyonuyla, her klorür iyonu da eşit uzaklıktaki altı sodyum iyonuyla çevrelenmiştir. Yapıdaki bütün bitişik sodyum ve klorür iyonları arasındaki kuvvetler eşittir. Bu nedenle de, sodyum klorür molekülü olarak ayırt edilebilecek belirli bir birim yoktur. Sonuç olarak sodvum klorür ve benzeri katı maddeler için (genellikle bütün tuzlar) molekül kavramının herhangi bir önemi yoktur. Bu tür bileşiklerin kimyasal formülü, atomların en basit oranı halinde verilir (sodyum klorür için NaCl).
Belirli bir molekülü oluşturan atomların uzamdaki dağılımı bu molekülün yapısı olarak tanımlanır. Yapı kimyasının konusu, atomların belirli oranlarda nasıl birleştiğini ve bunun bağ yönleri ve bağ uzunlukları ile olan ilişkisini belirleyen değerliktir (valans). Moleküllerin özellikleri yapılarıyla yakından bağıntılıdır; örneğin, su molekülü yapısal olarak eğiktir ve bu nedenle de bir dipol (çiftkutup) momentine sahiptir, buna karşılık karbon dioksit molekülü doğrusaldır ve bu nedenle de herhangi bir dipol momentine sahip değildir. Atomların kimyasal tepkime sırasında nasıl düzenlendiklerinin anlaşılması önemlidir. Atom çekirdekleri her zaman titreşim halindedir, ama bu titreşimlerin genliği genellikle moleküllerdeki atomların arasındaki bağ uzunluklarından çok daha küçüktür. Bazı moleküllerde sabit bir yapı bulunmayabilir; örneğin etan (H3CCH3) molekülünde, karbon-karbon bağı çevresinde hemen hemen serbest bir dönme söz konusudur.
Moleküllerde atomların konumu ve yerleşimi, mikrodalga titreşim-dönme tayfından ya da nötron kırınımından belirlenebilir. Moleküldeki çekirdekleri çevreleyen elektron bulutu ise X ışınları saçılımı deneyleriyle incelenebilir. Elektron spin (fırıl) rezonansı ya da nükleer magnetik rezonans teknikleriyle de daha ayrıntılı bilgiler edinilebilir. Kuramsal olarak molekül yapısı, çekirdek alanlarındaki elektronların devinimine ilişkin kuvantum mekaniği denkleminin (Schrödinger denklemi) çözülmesi yoluyla belirlenebilir. Molekül yapısındaki bağların uzunluğu ve aralanndaki açı, molekülün enerjisi en düşük düzeyde olacak biçimde düzenlenmiştir. Herhangi bir molekülün biçiminin ve yapısının açıklanmasında kimyasal bağ kuramlarından yararlanılır.
Bir molekülün molekül ağırlığı, onu oluşturan atomların atom ağırlıklarının toplamına eşittir. Molekül ağırlığı M olan bir maddenin M gramına, o maddenin bir molekül gramı ya da molü denir. Bütün maddelerin bir molekül gramındaki molekül sayısı aynıdır; buna Avogadro sayısı (6,023 x 1023) denir. Molekül ağırlıkları, kütle spektroskopisi yoluyla ve taşınım olaylarına ilişkin kinetik ya da termodinamik yasalarına dayalı tekniklerle belirlenir.
kaynak: Ana Britanica
Son düzenleyen Safi; 9 Aralık 2016 20:54

 Molekül Nedir? Moleküller ve Özellikleri Hakkında Genel Bilgiler
Molekül Nedir? Moleküller ve Özellikleri Hakkında Genel Bilgiler
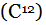 karşılaştırılması yoluyla belirlenir. Buna göre, oksijenin bağıl atom kütlesi (eskiden atom ağırlığı denirdi) 16'dır. Amonyağın (NH3) bağıl molekül kütlesi ise 17'dir, çünkü amonyak molekülü bir azot atomu (bağıl atom kütlesi 14) ile üç hidrojen atomundan (her birinin bağıl atom kütlesi 1) oluşur.
karşılaştırılması yoluyla belirlenir. Buna göre, oksijenin bağıl atom kütlesi (eskiden atom ağırlığı denirdi) 16'dır. Amonyağın (NH3) bağıl molekül kütlesi ise 17'dir, çünkü amonyak molekülü bir azot atomu (bağıl atom kütlesi 14) ile üç hidrojen atomundan (her birinin bağıl atom kütlesi 1) oluşur. i toplam 300.000 bileşik yapmaktadırlar. Ancak karbon olağanüstü bir şekilde tek başına tam 1.700.000 bileşik yapabilmektedir
i toplam 300.000 bileşik yapmaktadırlar. Ancak karbon olağanüstü bir şekilde tek başına tam 1.700.000 bileşik yapabilmektedir