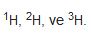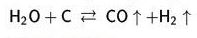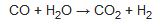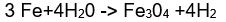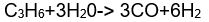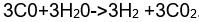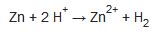HİDROJEN
(fr hydrogène).
Suyun bileşimine giren, gaz halindeki yalın cisim. (Simgesi H olan kimyasal element.)
Hidrojen iyonu, elektron yitirerek protona dönüşen hidrojen atomu. (Sulu çözelti durumundaki asitlerin özellikleri, bu iyonların varlığına bağlıdır. Bir ortamın asitliği ya da bazlığı, hidrojen iyonlarının derişimiyle [bir litre çözeltide bulunan H+ iyonları sayısı] belirlenir. Daha çok eşlogaritma ya da pH biçiminde kullanılır.)
Ask. Hidrojen bombası ya da H .bombası, termonükleer bomba.
Fizs. kim. Hidrojen bağı, flour, oksijen, azot gibi çok elektronegatif bir element ile hidrojen içeren iki molekül arasındaki birleşme biçimi. Hidrojen giderici, hidrojeni uzaklaştırmaya yarayan bir madde için kullanılır. Hidrojen giderme, hidrojen gidermek eylemi. Hidrojen gidermek, bir maddenin bileşiminde bulunan hidrojeni uzaklaştırmak.
Petrokim. Hidrojen giderme, bir madde içindeki hidrojeni eleme. Hidrojenle bitirme, bir petrol ürününe, hidrojenle işleyerek son kalitesini verme yöntemi.
ANSİKL. Simyacılar hidrojeni "tutuşkan hava" olarak biliyor, demir talaşı üzerine sülfürik asit dökerek elde ediyorlardı. Özellikleri ancak 1766'da Cavendish'in araştırmaları sonucu belirlenebildi.
Fiziksel Özellikleri
H2 molekülü. Hidrojen molekülü, birbirinden 0,75 Â uzaklıktaki iki atomun birleşmesinden oluşur. Aradaki bağ, iki elektronun ortaklaşa kullanılmasından meydana gelir ve çok yüksek olan ayrışma enerjisi (AH=+104 kcal- mol-1), molekülün çok kararlı olduğunu gösterir. Hidrojen, renksiz ve kokusuz bir gazdır Havaya göre yoğunluğu 0,07'dir ve bu bakımdan tüm cisimlerin en hafifidir. Dolayısıyla gözenekli çeperlerden diğer gazların tümünden daha hızlı geçer. Aynı şekilde kızıl derecedeki demir, platin ve iridyum gibi metallerden de sızar. Hidrojen, helyumdan sonra sıklaştırılması en zor gazdır. Dönüşül sıcaklığı -240°C olan hidrojen, atmosfer basıncında -253°C'ta kaynar, - 259°C'ta katılaşır. Oldukça iyi bir ısı ve elektrik iletkenidir. Özellikle kendi hacminin bin kat fazlasını çözündürebilen pal-ladyum gibi kimi metaller tarafından kolayca soğurulur.
Olağan hidrojen, molekül yapıları bakımından birbirinden farklı ortohidrojen ile parahidrojen gibi iki izomerinin karışımından oluşur. Ortohidrojen, oda sıcaklığında gazın dörtte üçünü meydana getirir; parahidrojenin oranı ise sıcaklık düştükçe artar. Parahidrojen ayrıca, ortohidroje-ne göre daha uçucudur. Öte yandan kusursuz bir elektrik iletkeni olması, karışımdaki niceliğinin belirlenmesini sağlar.
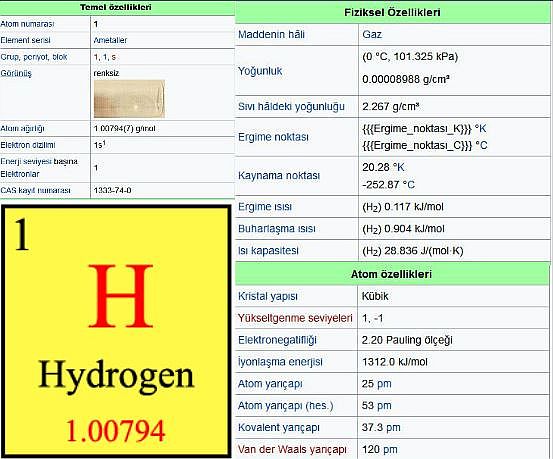
- Atom numarası: 1
- Atom kütlesi: 1,008 0
- Erime sıcaklığı: - 259,14°C
- Kaynama sıcaklığı: -252,87°C
- Özgül kütlesi: 0,071 g/cm3
- Yükseltgenme derecesi: +1
- Elektron biçimlenmesi: Is1
- izotopları: 1, 2 ve 3
- Doğal hidrojen: 1H: 99,985 2H: 0,015
Hidrojen iyonları. Hidrojen atomu, Is' şeklindeki elektron biçimlenmesiyle hemen her zaman ortak değerlikli bağlar oluşturur, ancak pozitif (H+) ya da negatif (H~ ) iyon durumunda da iyonlaşabilir. Hidrojenin H+ biçimindeki iyonlaşma potansiyeli, çok yüksektir (313 kcal- moM ya da 13,6 eV). Pozitif yükün yeğin bir elektrik alanı oluşturması nedeniyle H"1" iyonu, kutuplanabilir bir madde yanında tek başına bulunamaz. Nitekim hidrojen iyonu, suda H30+'ya, amonyakta ise NH4 'e dönüşür. H+ protonu, çözücü molekülüne bir elektron çiftiyle bağlanır. H+ iyonu, elektron ilgisi çok yüksek olan maddeler (halojenler) eşliğinde meydana ge-lebildiğijjibi, ayrıca HA asitlerinin suda H+ ve A biçiminde ayrışmasıyla da oluşabilir.
Hidrojenin elektron ilgisi zayıftır (0,65 eV). H~ iyonu, elektrik boşalmalı tüplerde, düşük bir hidrojen basıncının etkisiyle elde edilir. Ayrıca alkali metaller gibi çok elektropozitif maddelerle verdiği tepkimeler sırasında da oluşur.
Kimyasal Özellikler
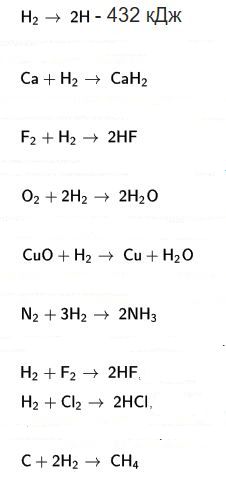
Hidrojen, etkinleştirilmiş biçimleri dışında, soğukta pek etkin değildir. Buna karşın, sıcakta ya da katalizörler eşliğinde pek çok tepkimeye girer. Birdeğerli bir element olması nedeniyle çok belirgin elektropozitif bir özellik taşır. Orta kuvvette bir indirgendir: alkali metal oksitler çok kararlı bileşikleri indirgeyemez. Bununla birlikte NİO, CuO, vb. gibi pek çok metal oksidi indirger Bu yolla katalizör olarak kullanılabilen çok ufaltılmış metaller elde edilir.
Hidrojen, alkali ve toprakalkali metallerle olduğu gibi, ametallerin çoğuyla da doğrudan birleşir. Halojenlerin dördüyle de tepkimeye girerek hidrasitleri verir: fluordan iyoda doğru gidildikçe hem tepkime hızında, hem de açığa çıkan ısı miktarında bir azalma görülür. Oksijenle, kızıl derecede ya da düşük sıcaklıkta bir katalizör eşliğinde (platin köpüğü) bileşerek su verir. Mavi bir alevle yanar, oksijenle karışımı, oksihidrojen hamlacında kullanılır. Kükürtle 250°C'a doğru birleşir. Azotla yüksek basınçta ve bir katalizör eşliğinde birleşerek amonyak elde edilmesini sağlar.
Hidrojen, özellikle oksijen ve klora karşı büyük ilgi gösterir ve bu maddeleri bileşiklerinden uzaklaştırır. Kükürt, azot, arsenik oksitlerinden ametali açığa çıkarır, kurşun ve bakır gibi değerli metallerin oksitlerini indirger. Demir ve demire yakın metallerin oksitleriyle tersinir tepkimeler verir.
Hidrojen, ayrıca karbonmonoksidi de indirger; işlemin gerçekleştirildiği koşullara uygun olarak (sıcaklık, basınç, katalizör) değişik ürünler oluşturur: - 250°C'ta indirgenmiş nikel (Ni) eşliğinde metan, elde edilir.
Katalitik hidrojenlenme tepkimeleri arasında taşkömürü yağlarının ya da taşkömürünün doğrudan kendisinin hidrojelenmesinin (sentetik yakıt üretiminde Bergius yöntemi) yanı sıra doymamış organik bileşiklere hidrojenin bağlanması da sayılabilir. Özellikle bu son tepkimeden sıvı yağların sertleştirilmesinde yararlanılır, indirgenecek madde, hidrojenin elde edildiği aynı ortama konulduğunda indirgeme koşulları daha uygun bir hale gelir. Bu sırada doğan hidrojen atom durumunda olduğundan büyük bir olasılıkla çok daha etkindir. Aynı şekilde hidrojen üretiminde kullanılan hidroklorik asit ve çinko karışımına sûlfit asidi katıldığında, hidrojensülfür (H2S) oluşur.
Elektrik arkına hidrojen üflendiğinde olağanüstü indirgen özellikler taşıyan bir gaz elde edilir: buna Langmuir'in atomsal hidrojeni denir. Atomsal hidrojen, tüm oksitleri indirger ve soğukta ametallerin çoğuyla birleşir.
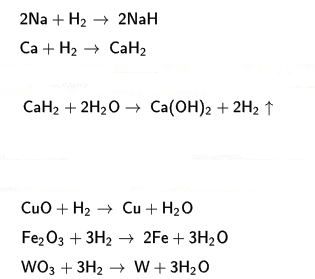
Hidrojenin, alkali ya da toprak alkali metaller üzerine etkimesi sonucu, iyonsal ya da tuz durumunda hidrürler elde edilir. Bunlar krlstalleşmiş tuzlardır. Alkali hidrürler, bor ya da alüminyumla LİAIH4 gibi çift hidrürleri oluşturur Bu bileşikten, organik kimyada özel olarak polar çifte bağların hidrojenlenmesinde yararlanılır.
Hidrojen, geçiş metalleriyle çoğu kez stokiyometrik olmayan aradurum bileşikleri oluşturur. Bu bileşiklerde hidrojen atomları, kristal örgüde atomlar arasındaki boşluklara yerleşir. Demir (Fe), nikel (Nl) ve özellikle palladyum (Pd) gibi kimi metaller, önemli miktarda hidrojen soğurur. Böylece oluşan metal hidrürler, daha çok katalitik özellikleri nedeniyle kullanılır. Hidrojenle çalışan uzay araçlarında yakıt olarak kullanılan hidrojenin depolanması konusunda kimi metal hidrürler üzerindeki araştırmalar sürdürülmektedir.
Doğal Durumu
Hidrojen, evrende en bol bulunan bir element gibi gözükmesine karşın, Yer'de ilk sırayı almaktan uzaktır. Atmosferde az miktarda bulunur (3/10 000 hacim). Volkanlardan püsküren ya da doğal kaynaklardan çıkan gazlardaki oranı çok daha yüksektir. Suda, anorganik pek çok cisimde, organik maddelerin tümünde bileşmiş olarak bulunur. Yıldızlararası soğuk bölgede, dalga boyu 21 cm olan bir tayf çizgisinin yayınımı sonucu yansız durumda gözlenir. H11 bölgelerinde olduğu gibi sıcak yıldızların yakınında iyonlaşabilir. (üretimi Hidrojen sanayide sudan ya da hidrojen içeren gaz karışımlarından (doğal gaz, kokhane gazı, petrol gazı) elde edilir.
Ayrıca sudan, demir elektrotlar eşliğinde sodyum hidroksit ya da sulu bir alkali karbonat çözeltisinin elektrikle ayrıştırılması sonucu özütlenlr. Bu sırada katotta hidrojen, anotta oksijen açığa çıkar.
Su buharı 1000°C'a doğru karbonla indirgenir. Bu sırada özellikle hidrojen ve bir karbonmonoksit karışımı olan "su gazı" elde edilir:
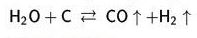
Karışım, demir oksitten oluşan bir katalizör üzerinden geçirildiğinde,
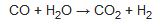
tepkimesi görülür Ayrıca su buharının demirle indirgenmesi yönteminden de yararlanılır:
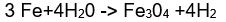
Demir, karbonmonoksit etkisiyle yenileştirlllr ve bu yöntem, bir öncekiyle birleştirilebilir.
Hidrojen temel olarak su buharının hidrokarbonlar üzerine etkimesi sonucu üretilir. Bu amaçla hidrokarbon karışımları, yani ham petrol krakinginden elde edilen yan ürünler kullanılır Boksit üzerinden geçirilerek kükürtten arındırılan gaz evre, su buharıyla karıştırıldıktan sonra 800°C'ta nikel bir katalizör üzerine gönderilir. Bu sırada aşağıdaki tepkime oluşur:
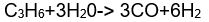
Fırından çıkan sıcak gazlara yeniden su buharı katıldığında sıcaklık 400°C'a dek düşer ve bu sırada ikinci bir tepkime görülür:
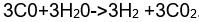
Gaz karışımı, ısıtılarak yenileştirilen eta-nolamin çözeltisiyle yıkanır ve hidrojen karbondioksitten arındırılır.
Hidrojen genellikle hidrokarbonların oktan indisini artırmaya yarayan arıtma işlemleri sırasında büyük miktarda üretilir. Uygulanan tepkime, naftalen ve parafinlerin hidrojeni giderilerek aromatik hidrokarbonlara dönüştürülmesidir.
Amerika'da üretilen doğal gaz ya da kokhane gazları, %50 oranında hidrojen içerir. Benzoller, diğer hidrokarbonlar, karbondioksit ve sudan arındırılan gaz, basınçla sıkıştırılır, hidrojen ve azot dışında tüm gazları yoğuşturan sıvı azotla işlenir.
Hidrojen laboratuvarda genellikle seyreltik hidroklorik asit, çinko üzerine etki ettirilerek elde edilir:
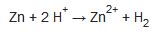
Gaz, hafifliği nedeniyle bir tank içinde suyla yer değiştirerek suyun üzerinde toplanır. Ayrıca sürekli üretim aygıtları da vardır.
Kullanım Alanları
Hidrojen, sanayi gazlarının en önemlisidir. Serbest durumda balonların şişirilmesinde uzun süre kullanıldı. Ancak tutuşması yüzünden pek çok kazaya yol açtı (Akron, Hindenburg vb.); bundan dolayı yerini, hafifçe ağır olmasına karşın özellikle tutuşmaması nedeniyle helyuma bıraktı. Hidrojen ayrıca, pek çok kimyasal işlemde hammadde olarak kullanılır.
Sanayisel olarak üretilen hidrojen, temel olarak aşağıdaki katalitik hidrojenleme tepkimelerinde tüketilir:
Haber yöntemiyle amonyak (NH4) bireşimi;
metanol (CH3OH) bireşimi;
bitkisel yağlan doyurma;
alkenleri "okso yöntemiyle aldehit ve alkollere hidroformilleme;
petrokimyada hidrojenle işleme.
Sıvı hidrojen, genellikle uzay araçlarının fırlatıcılarını itmede yakıt olarak kullanılır. Bu durumda çoğu kez, sıvı oksijen gibi bir yakıtla tepkimeye sokularak aracın olağanüstü bir hıza (4 500 m/sn'nin üzerinde) erişmesini sağlar. Nükleer ya da güneş kökenli elektrikle suyun elektrolizi sonunda üretilen hidrojen, verimin artırılması ve fiyatların düşürülmesi durumunda geleceğin önemli bir enerji kaynağı olabilir.
Biyokim. Hidrojensizleşme biyolojik yükseltgenmelerin olağan biçimidir. Bir dezhidrojenazın etkisi altında organik bir bileşiğin hidrojen açığa çıkarmasıyla gerçekleşir.
Fizs. kim. Hidrojen bağı. Bu bağ, bir molekülün pozitif kutbunu oluşturan hidrojenle, bir başka molekülün negatif kutbunu oluşturan atom arasındaki elektrostatik çekimden ileri aelir. Bu bağ göreli olarak daha uzun (3A), sıradan ortak değerlikli bağlarla karşılaştırıldığında daha az kuvvetlidir. Buna karşın bilinen moleküllerarası Van der Waals çekim kuvvetlerinden daha güçlüdür. Hidrojen bağı, buz ve sudaki H20 molekülleri ile sıvı amonyaktaki NH3 moleküllerinin birleşmesini gösterir; kaynama noktalarının, ısıl büyüklüklerin, dielektrik değişmezinin aşırı ölçüde yüksek olması, hidrojen bağlarından kaynaklanır. Organik kimyada çok sık karşılaşılan hidrojen bağı (alkol molekülleri), biyokimyada da önemli bir rol oynar (proteinlerin yapısı).
Jeokim. D-H parçalanma mekanizması, sıvı evrenin buhar evresine oranla döteryumca zenginleşmesine yol açar. Nitekim doğada, suyun çevriminde karşılaştırma standardı olarak benimsenen okyanus suyunun buharlaşması, buhar evresinde hafif H izdtopunun derişimini kolaylaştırır ve bu buharın yoğuşması da me-teorik suları oluşturur. Buharlaşmanın yeğin olduğu kuşaklarda tuz bakımından çok yüklü olan sular, döteryumca çok zenginleşir. Döteryum ile oksijenin O18 izotopu arasında meteorik suları belirleyen bir bağıntı vardır; bu yüzden sözkonusu izotop jeotermal suların kökenini saptamada kullanılır.
Petrokim. Alifatik ya da halkalı doymuş hidrokarbonlara uygulanan hidrojen gidermeyle arıtmada ve petrokimyada çok büyük önemi olan olefinler ve aromatik hidrokarbonlar elde edilir. Böylece, katalitik reformingde sikloheksanlı naftenlerin hidrojeni elenir; hidrojeni giderilmiş ve halkalaştırılmış parafinler, üretilen benzine yüksek bir oktan indisi kazandıran benzenik hidrokarbonlar verir. Etanın buharla krakinginde, ısıl hidrojen gidermeyle etilen üretilir. Kimi katalizörler, stirolen elde etmek için etilbenzenin ve butadien elde etmek İçin de bütanın (ya da n butenler) hidrojenini gidermeyi sağlar; bu ürünler kauçuk bireşiminin temel maddesini oluşturur.
MsXLabs.org & Büyük Larousse
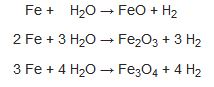
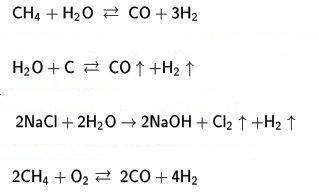


 Elementler - Hidrojen
Elementler - Hidrojen